2020盤點:美國及歐盟批準的新藥
發布日期:2021-01-04 閱讀次數:568 來源:中國食品藥品網
摘要:
盡管2020年新冠肺炎疫情對制藥行業的新藥開發計劃均造成了較大的影響,但從2020年美國和歐盟批準新藥數量來看,兩個監管機構藥品審批速度絲毫沒有放緩。
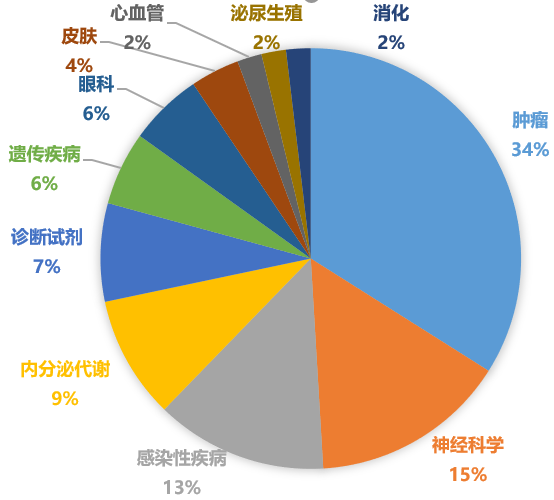
2020年美國FDA批準新藥的適應證分布
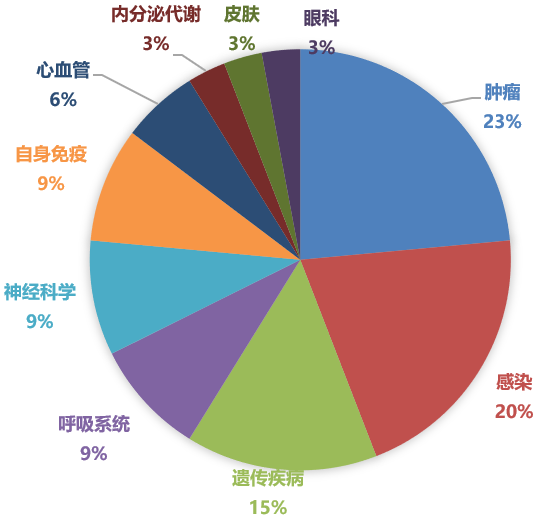
2020年歐盟EMA批準新藥的適應證分布
從疾病領域來看,據Pharmadigger數據庫統計,2020年FDA批準的新藥1/3為腫瘤藥,其次是神經科學和感染性疾病等藥物;EMA批準的新藥情況類似,腫瘤藥占主要適應證領域,其次是感染性疾病和遺傳疾病。
從批準的時間來看,FDA批準的新藥多數為全球首批;而歐盟方面,僅有6個藥物為全球首批。一是由于美國新藥開發環境更活躍,專注于新藥研發的公司數量較多,FDA對于授予孤兒藥資格或加速審評等促進新藥開發的態度更開放;二是EMA審批流程更復雜,由于EMA的人用藥品委員會(CHMP)的成員來自歐盟各國,自2005年11月以來,所有的腫瘤、罕見病、自身免疫、糖尿病的新藥和基因療法必須通過EMA集中審批程序,但隨著歐盟的擴大,架構和平均審評耗時不可避免地會比FDA更繁雜。
2020年同時在FDA和EMA獲批的新藥
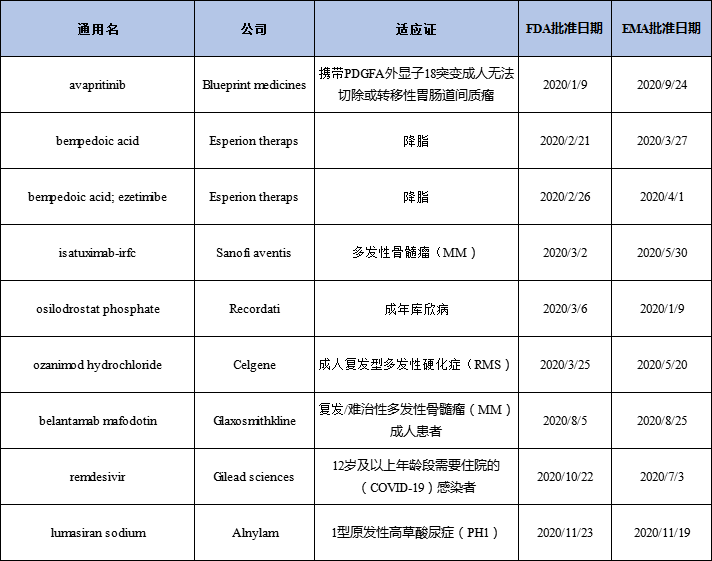
Esperion公司兩個口服降膽固醇藥物Nexletol(bempedoic acid)和Nexlizet(bempedoic acid and ezetimibe)在美國和歐洲市場獲得批準,且銷售開局較好。
2020年獲得過FDA突破性療法資格授予的新藥

ADC領域整體勢頭不減。繼2019年批準3款ADC藥物之后,2020年FDA通過突破性療法批準2款首個針對靶點的上市藥物。Sacituzumab govitecan是第一款上市的靶向Trop-2藥物,基于一項納入108例轉移性三陰性乳腺癌患者的單臂臨床II期試驗結果,總緩解率(ORR)為33.3%,中位緩解持續時間為7.7個月。Belantamab mafodotin是第一款上市的靶向BCMA的藥物和ADC,適應證為既往至少經歷了4線治療(包含CD38靶向性抗體)的復發/難治型多發性骨髓瘤,ORR為31%。
首個抗體藥物復方制劑Inmazeb于2020年10月14日獲批用于埃博拉病毒感染,該制劑由3種單克隆抗體(Atoltivimab + Odesivimab + Maftivimab)組成,三個抗體都具有相似結構,靶向結合于埃博拉病毒表面糖蛋白不同位點,通過阻斷病毒的附著侵入、招募免疫細胞以感染細胞為目標來中和病毒。
有些在FDA獲批的新藥已被中國藥企引進,這也大幅提高了國內開發的成功率。如基石藥業引進的普拉替尼,于2020年9月4日獲批用于RET融合陽性的成人轉移性NSCLC;恩華藥業從Trevena引進了阿片類藥物oliceridine的開發和商業化權益,用于治療中重度急性疼痛,交易價值約一千萬美元。
2020年在EMA全球首批的新藥有6個,其中2個在FDA也獲得批準,分別為RNAi療法Lumasiran和osilodrostat,其余4個新藥均未在2020年獲得FDA批準上市。吉利德的filgotinib2020年8月在FDA的上市申請遭到拒絕,在完全回復函(CRL)中,FDA表示了對200mg劑量filgotinib的整體收益風險狀況的擔憂,目前FDA表示需要通過對來自于MANTA和MANTA-RAy臨床研究的數據以完成上市審評。但該藥2020年9月24日在歐盟獲批上市。
2020年在EMA全球首批的新藥
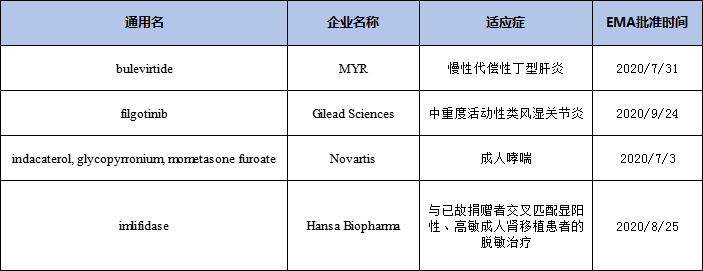
另外兩家歐洲公司選擇在歐洲先申請新藥上市,分別是位于德國專注于開發治療丁肝病毒感染新藥的生物技術公司MYR GmbH,其主打Hepcludex? (bulevirtide)在2020年7月獲得了歐盟的有條件批準上市,用于治療伴有代償性肝病的成人慢性丁肝患者,這是全球首個獲批用于治療丁肝的新藥。2020年12月10日,吉利德宣布以11.5億歐元現金收購MYR GmbH。另一家是位于瑞典的致力于開發治療IgG介導罕見疾病創新療法的Hansa Biopharma公司,2020年8月獲EMA有條件批準其IgG裂解酶Idefirix(imlifidase)上市,用于治療高致敏腎移植患者,其能快速特異性靶向IgG并抑制IgG介導的免疫應答,在給藥后幾小時內裂解IgG抗體并抑制其活性。該藥曾獲歐盟EMA授予的PRIME藥品認定。(陳倩)














