罕見病新藥「炸裂之月」
發布日期:2024-03-13 閱讀次數:1114 作者:宇舟 來源:藥智網
摘要:
據悉,2024年2月29日是第十七個國際罕見病日,而2月的獲得NMPA批準上市的罕見病新藥就有4款,再掀小高潮。
除了罕見病新藥外,不用冷藏、不含輔助蛋白的第五款肉毒素——Xeomin(西馬)也成功上市。
以下為2月CDE藥審報告分析。
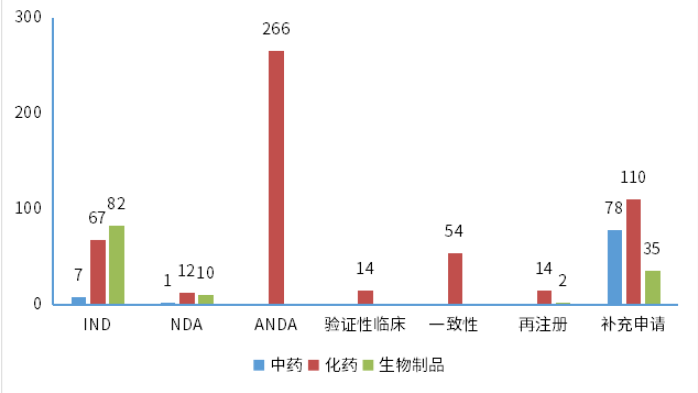
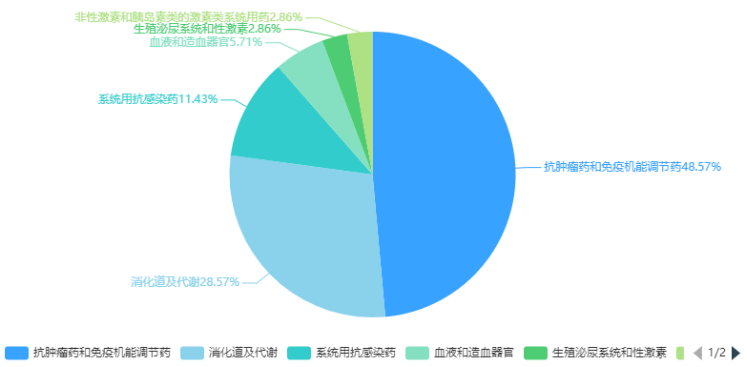
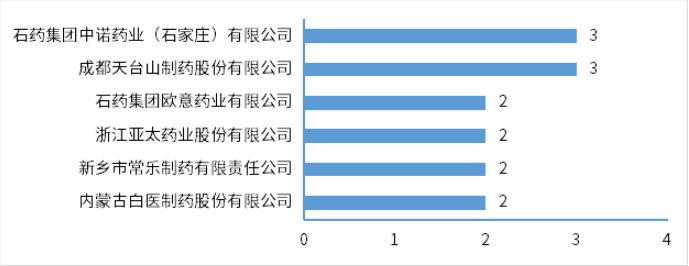
根據藥智數據企業版——藥品注冊與受理數據庫最新統計,2024年2月份CDE共承辦新的藥品注冊申請以品種(按藥品+企業維度)統計共有911個,同比減少23.45%,其中化藥615個品種,中藥163個品種,生物制品133個品種,以受理號計共1215個。以注冊申請審評任務類型統計,受理新藥臨床試驗申請(以下簡稱IND)156個品種(受理號245個);新藥上市許可申請(以下簡稱NDA)23個品種(受理號34個);同名同方藥、仿制藥、生物類似藥上市許可申請(以下簡稱ANDA)266個品種(受理號316個);仿制藥質量和療效一致性評價注冊申請(該注冊申請類別以下簡稱一致性評價申請)54個品種(受理號79個);各申請類別注冊申請受理品種情況詳見圖1。2024年2月份(注:狀態開始時間(藥智)從2024年2月1日至2024年2月29日)完成審評的品種共714個(受理號980個),同比增長10.19%。其中化藥完成審評443個品種,中藥審評完成162個品種,生物制品完成審評109個品種。(注:完成審評的數據統計截至2024年3月11日)藥智收錄到結論的數量為690個品種(950個受理號),對有結論的藥品類型進行分析統計,其中中藥品種159個(163個受理號),化藥品種432個(649個受理號),生物制品品種99個(138個受理號)。2024年2月注冊申請完成審評結論品種統計詳情情況見圖2。2024年2月份,1類創新藥注冊申請受理132個品種(受理號206個),以注冊申請審評任務分類統計,IND申請127個品種(受理號197個);NDA申請5個品種(受理號9個)。改良型新藥注冊申請受理32個品種(受理號54個),以藥品類型分類統計,改良型中藥受理1個品種(受理號1個),改良型化學藥20個品種(受理號35個),改良型生物制品11個品種(受理號18個)。適應癥包含抗腫瘤領域、消化道及代謝等。2024年2月創新藥與改良型新藥注冊申請受理情況詳見表一,2024年2月注冊申請受理創新藥、改良型新藥ATC分布情況詳見圖3。表一 2024年2月創新藥與改良型新藥注冊申請受理情況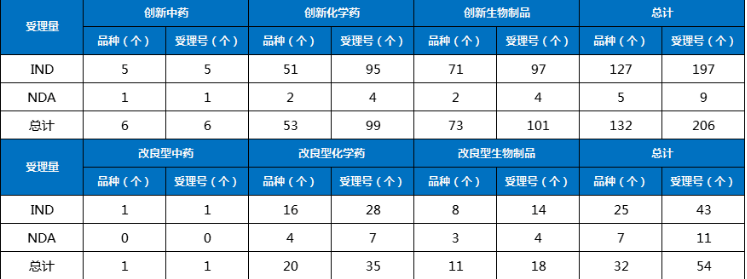
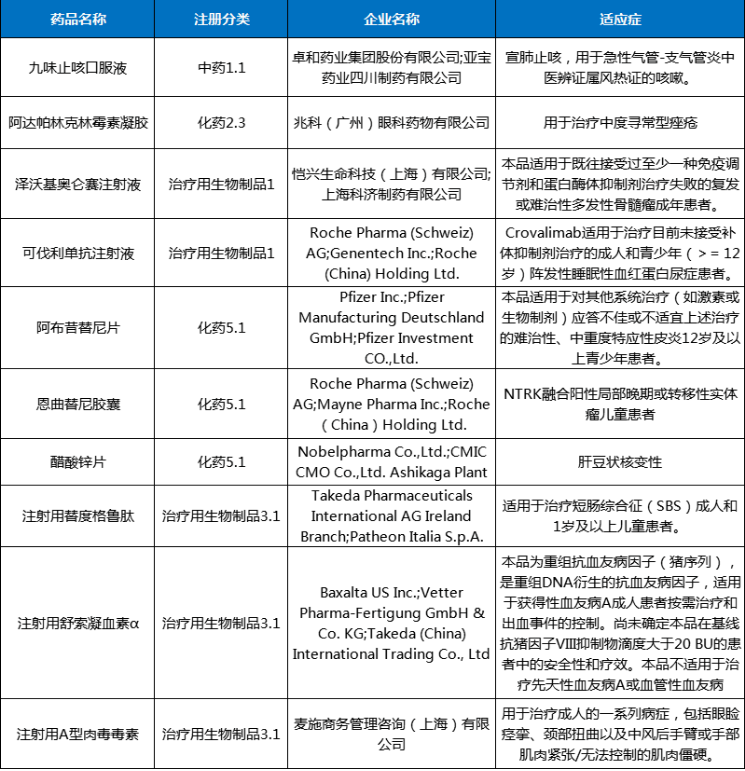
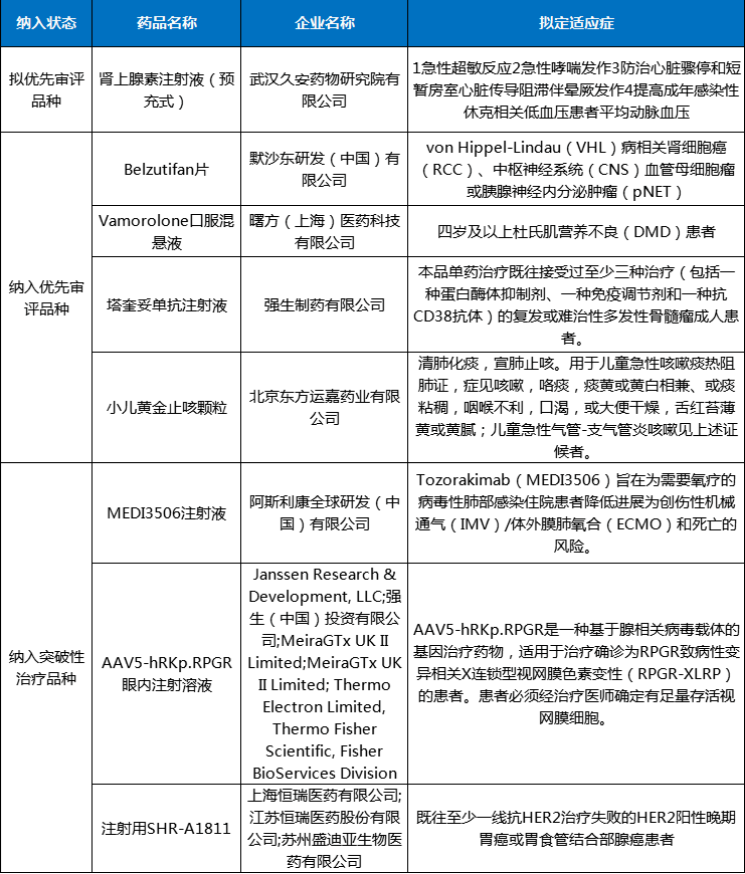
圖3 2024年2月注冊申請受理創新藥、改良型新藥ATC分布情況2024年2月份,創新藥與改良型新藥獲批上市共計4個品種(受理號4個),分別是中藥1.1類的九味止咳口服液、化藥2.3類的阿達帕林克林霉素凝膠、治療用生物制品1類的澤沃基奧侖賽注射液和可伐利單抗注射液。2月份進口原研藥品上市品種有6個,其中化藥3個品種,生物制品3個品種。2024年2月創新藥與改良型新藥以及進口原研藥品獲批上市品種情況詳見表二。表二 2024年2月創新藥、改良型新藥及進口原研藥品獲批上市情況2024年2月29日是第十七個國際罕見病日,罕見病(Rare Diseases)通常是指發病率很低的疾病,世界衛生組織將患病人數占總人口0.065%-0.1%之間的疾病定義為罕見病。在剛剛過去2月獲得NMPA批準上市的可伐利單抗注射液、注射用舒索凝血素α等罕見病新藥為部分罕見病患者帶來了新選擇。陣發性睡眠性血紅蛋白尿癥(PNH),是一種罕見且危及生命的血液疾病,患病后,患者的紅細胞會被補體系統(天然免疫系統的一部分)破壞,在沒有接受補體抑制劑治療的情況下,患者5年內死亡的風險達35%。可伐利單抗注射液是一種靶向補體蛋白C5的重組人源化IgG1亞型單克隆抗體,能特異性地與補體蛋白C5結合,抑制補體途徑免疫反應。獲得性血友病A,該病年發病率約為1.5/100萬,該病死亡率為6.7%,主要死亡原因包括出血、基礎疾病以及繼發于免疫抑制治療的嚴重感染等。注射用舒索凝血素α是一款重組抗血友病因子(豬序列),是重組DNA衍生的抗血友病因子,與人序列凝血因子Ⅷ結構相似,序列同源,而且不容易受到抗人FⅧ自身抗體的滅活,可以替代人FⅧ發揮明顯的止血作用。肝豆狀核變性(又稱Wilson病,威爾遜病),是一種常染色體隱性遺傳病。該病發病年齡多為3-60歲,兒童患者多以肝臟受累為首發表現。醋酸鋅片是一種銅吸收抑制劑,可阻止吸收來自飲食的銅,同時阻止內源性銅(來自唾液、膽汁、胃液)的重吸收。2024年2月份,CDE共將1個品種納入擬優先審評品種公示名單,以及有4個品種正式納入優先審評,納入理由包含納入突破性治療藥物程序、符合附條件批準的藥品以及其他優先審評審批情況;3個品種(受理號CXSL2000087、JXSL2300147、JXSL2300148、JXSL2300004)納入突破性治療品種名單。2024年2月優先審評與突破性治療品種名單詳見表三。2024年2月份,CDE共受理一致性評價品種54個(受理號79個),石藥集團中諾藥業(石家莊)有限公司申報有注射用阿莫西林鈉克拉維酸鉀、注射用頭孢哌酮鈉舒巴坦鈉、注射用頭孢米諾鈉3個品種,與申報硫酸阿米卡星注射液、鹽酸納洛酮注射液、注射用生長抑素3個品種的成都天臺山制藥股份有限公司,是2月份申報一致性評價最多品種的兩個公司。2024年2月各企業申報一致性評價品種TOP6見圖4。一致性評價完成審評品種46個(受理號67個),天津金耀藥業有限公司的鹽酸甲氧氯普胺注射液、國藥一心制藥有限公司的注射用達卡巴嗪、雙鶴藥業(海南)有限責任公司的氯氮平口腔崩解片、安徽貝克生物制藥有限公司的齊多拉米雙夫定片4個品種為首家通過一致性評價。其中齊多拉米雙夫定片已在2021年3月由上海迪賽諾生物醫藥有限公司獲批首家視同通過一致性評價。2024年2月通過一致性評價品種名單詳見表四。