分子細胞卓越中心等建立基于人內胚層干細胞的規模化肝向分化系統
發布日期:2021-01-05 閱讀次數:505 來源:中國科學院官網
摘要:
近期,中國科學院分子細胞科學卓越創新中心研究員程新、北京大學生命科學學院教授徐成冉、分子細胞卓越中心研究員陳洛南和上海長征醫院教授殷浩合作,在Cell Reports上,發表題為Large-scale Generation of Functional and Transplantable Hepatocytes and Cholangiocytes from Human Endoderm Stem Cells的研究成果。
肝臟由肝實質細胞(hepatocytes)和膽管上皮細胞(cholangiocytes)等多種細胞構成,其損傷及功能紊亂會嚴重影響人類健康。肝臟移植是目前治療終末期肝病最有效的手段之一,但其應用受制于供體匱乏。體外再造肝臟組織/器官是解決供體來源的有效途徑,但也受制于肝臟細胞的來源限制。此外,肝臟細胞的來源短缺和肝組織體外模型的缺失制約了藥物篩選及毒理研究。由于肝臟包含超過1011的肝實質細胞和約1010的膽管上皮細胞,上述應用對肝臟細胞的來源、數量、純度、質量及安全性等方面提出了要求。因此,建立高效的肝臟細胞體外規模制備及質檢體系是應對該挑戰的較好選擇,其也成為當今轉化醫學研究的熱點和難點。
為了滿足肝病治療及體外藥物篩選等應用對肝臟細胞在數量、質量及安全性等方面的要求,研究人員建立了高效的基于人內胚層干細胞系(hEnSCs)的體外規模化肝向分化體系,使規模制備高純度的肝母細胞、肝實質細胞(E-heps)及膽管上皮細胞(E-chos)成為可能。研究人員利用單細胞轉錄組測序技術,深入解析了該體系各關鍵分化步驟的細胞群體,并與原代及其他來源的肝實質細胞進行了系統的對比。功能實驗顯示,E-heps和E-chos具有成體細胞的分泌、代謝及解毒功能;包囊化的E-heps經移植后可挽救急性肝衰動物;E-chos在小鼠腎包囊下可形成膽管網絡。該研究為肝病治療及疾病模擬提供了細胞規模制備及質檢體系。
該研究建立的基于人內胚層干細胞的規模化肝向分化系統為體外藥物篩選、肝病模擬、肝臟體外構建以及肝病細胞治療等應用奠定了技術及理論基礎。未來的研究方向將聚焦于體系的優化完善,包括尋找更優的起始種子細胞類型(如雙潛能的肝干細胞系等)、進一步降低終末分化細胞的群體異質性、進一步提高終末分化細胞體內整合及再殖能力,進而探索利用體外制備的肝臟細胞構建血管化和膽管化的肝組織以及肝病細胞治療的可行性。
該研究主要由分子細胞卓越中心程新組博士馮思思、吳佳穎和鄧小剛與陳洛南組博士邱偉林以及北京大學徐成冉組博士楊李共同完成,程新、徐成冉、陳洛南和殷浩為論文的共同通訊作者。研究工作得到國家重點研發計劃項目、中科院戰略性先導科技專項和國家自然科學基金,以及動物平臺、細胞分析平臺和分子生物學平臺等的支持,獲得分子細胞卓越中心研究員惠利健和中科院上海藥物研究所研究員潘國宇的指導和幫助。
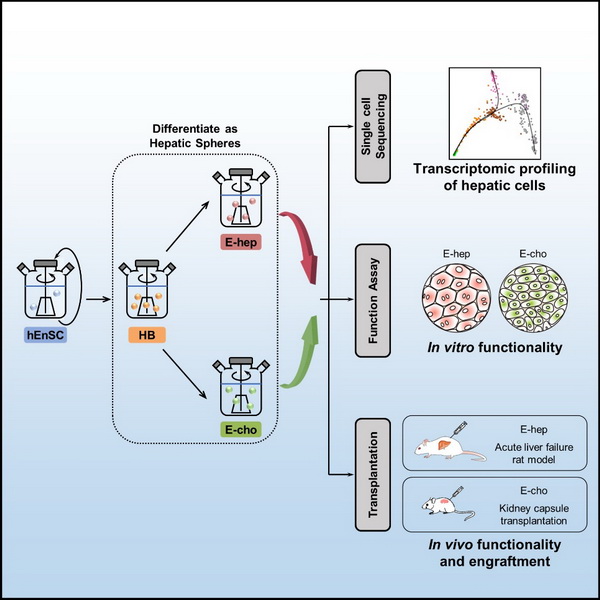
基于人內胚層干細胞的規模化肝向分化系統














