盤點10月份中美歐批準上市的新藥
發(fā)布日期:2020-11-11 閱讀次數(shù):533 來源:中國食品藥品網(wǎng)
摘要:
2020年10月,中國、美國和歐盟獲批的新藥數(shù)量不多,最受關(guān)注的還是美國批準上市的兩個抗病毒新藥。
美國
2020年10月,美國FDA批準兩款藥物上市,都是抗病毒新藥——Inmazeb(atoltivimab+maftivimab+odesivimab)和Remdesivir。埃博拉病毒和COVID-19都是對人類公共衛(wèi)生帶來極大危害和破壞的病毒,這兩款藥都是世界上首個獲批用于這兩種病毒的治療用藥。
表1 2020年10月美國批準上市的新藥
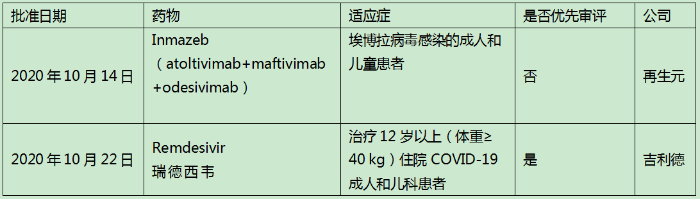
再生元的Inmazeb是由三種全人源IgG1單克隆抗體(atoltivimab、maftivimab、odesivimab-ebgn)組合而成的雞尾酒療法,三個抗體都具有相似結(jié)構(gòu),靶向結(jié)合于埃博拉病毒表面糖蛋白不同位點,通過阻斷病毒的附著侵入、招募免疫細胞以感染細胞為目標來中和病毒。FDA批準基于一項III期試驗, 681例患者隨機平均分配接受4種療法的治療,包括抗體雞尾酒療法ZMapp、三抗雞尾酒療法Inmazeb(REGN-EB3)、單抗mAb114和瑞德西韋。
結(jié)果顯示,28天時各組死亡率:MAb114組35.1%(61/174),ZMapp組49.7%(84/169),Inmazeb(REGN-EB3)組33.5%(52/155),瑞德西韋組53.1% (93/175)。Inmazeb治療組在死亡率方面低于ZMapp和redesivir治療組。安全性方面,常見的不良反應為寒戰(zhàn)、發(fā)熱、心動過速、呼吸急促、嘔吐、低血壓、腹瀉和組織供氧不足。
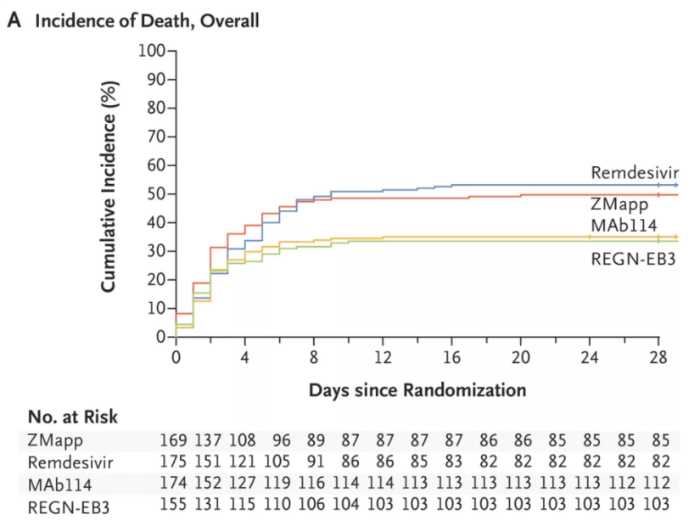
Inmazeb用于埃博拉病毒的III期臨床試驗結(jié)果。
瑞德西韋的研發(fā)進展一直備受關(guān)注,其在5月1日曾獲得FDA的緊急使用授權(quán)(EUA)。此次獲得FDA正式批準是基于三項隨機對照試驗,包括近期發(fā)布的美國國家過敏和傳染病研究所(NIAID)的雙盲、安慰劑對照Ⅲ期ACTT-1試驗最終結(jié)果。據(jù)悉,瑞德西韋針對兒科患者的安全性和療效臨床試驗正在進行中。
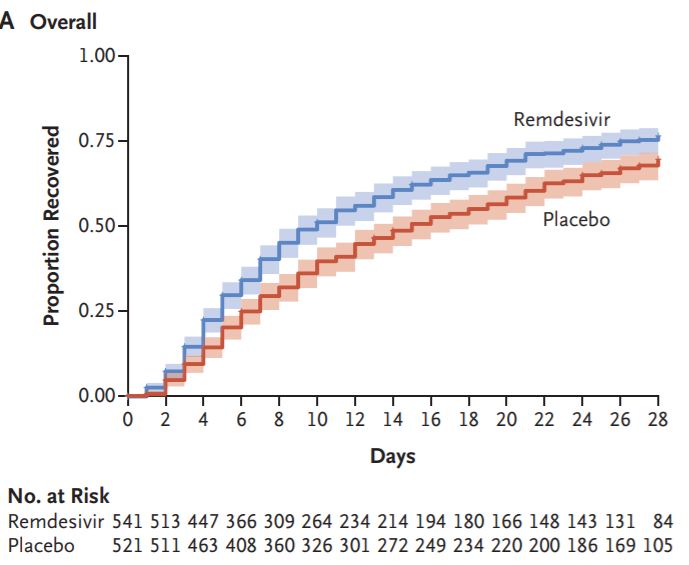
ACTT-1試驗結(jié)果
歐盟
歐盟10月份批準了兩款孤兒藥上市,這兩款藥物此前都已經(jīng)在美國獲批上市。
表2 2020年10月歐盟批準上市的新藥

諾華的Adakveo于2019年11月在美國獲得全球首批,是第一個被批準可用于鐮狀細胞病患者預防VOC的靶向療法,同時是第一個也是唯一一個被批準的通過結(jié)合P選擇素(P-selectin)發(fā)揮治療作用的靶向生物制劑。P-選擇素是一種細胞粘附蛋白,在導致血管阻塞的多細胞相互作用中起著中心作用。通過與活化的內(nèi)皮細胞和血小板表面的P-選擇素結(jié)合,Adakveo可阻斷內(nèi)皮細胞、血小板、紅細胞和白細胞之間的相互作用。
多年來,SCD僅有一種治療性藥物--羥基脲(Hydroxyurea),這種化療藥物能降低VOC 50%的發(fā)生率,但會引起嚴重的毒副反應,具有致癌風險,使用受到限制。此次批準基于一項名為SUSTAIN的II期臨床研究,旨在評估Adakveo聯(lián)用或不聯(lián)用羥基脲預防SCD患者經(jīng)歷VOC的療效和安全性。數(shù)據(jù)顯示,與安慰劑相比,Adakveo(5mg/kg)將VOC中位年發(fā)病率顯著降低了45.3%(1.63 vs 2.98,p=0.01),Adakveo組在治療期間沒有經(jīng)歷任何VOC的患者比例是安慰劑組的2倍以上(35.82% vs 16.92%,p=0.013)。
Insmed公司阿米卡星脂質(zhì)體吸入懸液Arikayce于2018年9月在美國獲得全球首批,也是目前唯一獲批治療MAC肺部疾病的藥物,治療由鳥型分枝桿菌(MAC)導致的非結(jié)核分枝桿菌(NTM)肺部感染。Arikayce是一種新型的、每日一次的、吸入用阿米卡星制劑,阿米卡星是一種針對多種NTM有治療作用的氨基糖苷類抗生素,但需要靜脈給藥,因?qū)β犃Α⑵胶夂湍I功能有嚴重毒性而使用受限,所以吸入懸液可以提高患者依從性。此次批準基于一項全球III期臨床CONVERT,與標準治療多藥方案(MDR)相比,Arikayce聯(lián)合MDR可顯著提高痰培養(yǎng)轉(zhuǎn)化率(p<0.0001),兩組NTM肺病證據(jù)消除的患者比例分別為29%和9%。
中國
在中國,生物類似藥的市場競爭在加速。9月信達生物的阿達木單抗生物類似藥剛被批準,10月利妥昔單抗生物類似藥獲批,這是信達生物獲批上市的第4個單抗類藥物,前3個為信迪利單抗注射液、貝伐珠單抗生物類似藥和阿達木單抗生物類似藥,可見信達生物研發(fā)速度之快。
表3 2020年10月中國批準上市的新藥

利妥昔單抗的原研是羅氏重磅炸彈藥物美羅華,在中國第一個上市的利妥昔單抗生物類似藥是復宏漢霖的漢利康,于2019年2月首次獲國家藥監(jiān)局批準;2019年,復宏漢霖利妥昔單抗注射液銷售額約為1.5億元。國內(nèi)開發(fā)美羅華類似物并注冊申報的企業(yè)已經(jīng)超過10家,包括三生國健、海正藥業(yè)、正大天晴、華蘭生物、麗珠單抗等。(陳倩)














