又有23個兒童藥鼓勵研發,上市后醫保、基藥目錄都支持!(附1-5批名單)
發布日期:2024-05-30 閱讀次數:721 作者:子非魚 來源: 醫藥云端工作室
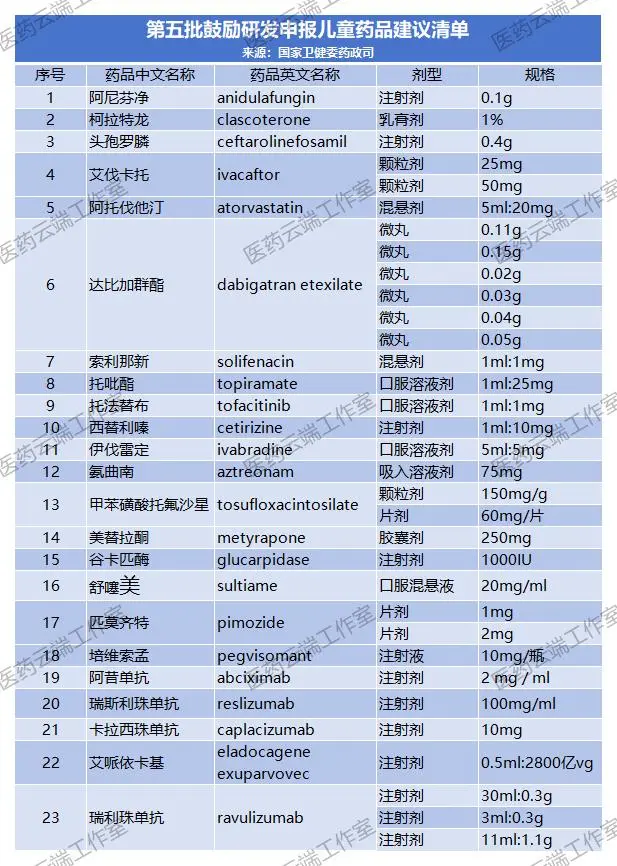
摘要:5月30日,國家衛健委官網公示《第五批鼓勵研發申報兒童藥品建議清單》,此次公示23個品種,包括阿托伐他汀混懸劑、托法替布口服溶液劑、西替利嗪注射劑、氨曲南吸入溶液劑等,這些品種目前口服常釋劑型都早已在國內上市,而混懸劑、口服溶液等劑型還未上市,相信在政策推動下企業加大研發力度可以早日實現臨床獲益。
5月30日,國家衛健委官網公示《第五批鼓勵研發申報兒童藥品建議清單》,此次公示23個品種,包括阿托伐他汀混懸劑、托法替布口服溶液劑、西替利嗪注射劑、氨曲南吸入溶液劑等,這些品種目前口服常釋劑型都早已在國內上市,而混懸劑、口服溶液等劑型還未上市,相信在政策推動下企業加大研發力度可以早日實現臨床獲益。(23個公示品種清單見文末)
公示顯示,為進一步落實原國家衛生計生委等6部門《關于保障兒童用藥的若干意見》要求,豐富兒童適用藥品的品種、劑型和規格,滿足兒科臨床用藥需求,2024年,國家衛生健康委、工業和信息化部和國家藥監局繼續緊密圍繞我國兒童疾病譜以及相關企業研發生產能力,組織臨床、藥學、研發、注冊等有關專家結合中國大陸境內尚未注冊上市且臨床急需的兒童用藥現狀,基于循證原則篩選論證,提出了《第五批鼓勵研發申報兒童藥品建議清單》。現予以公示,公示5個工作日。
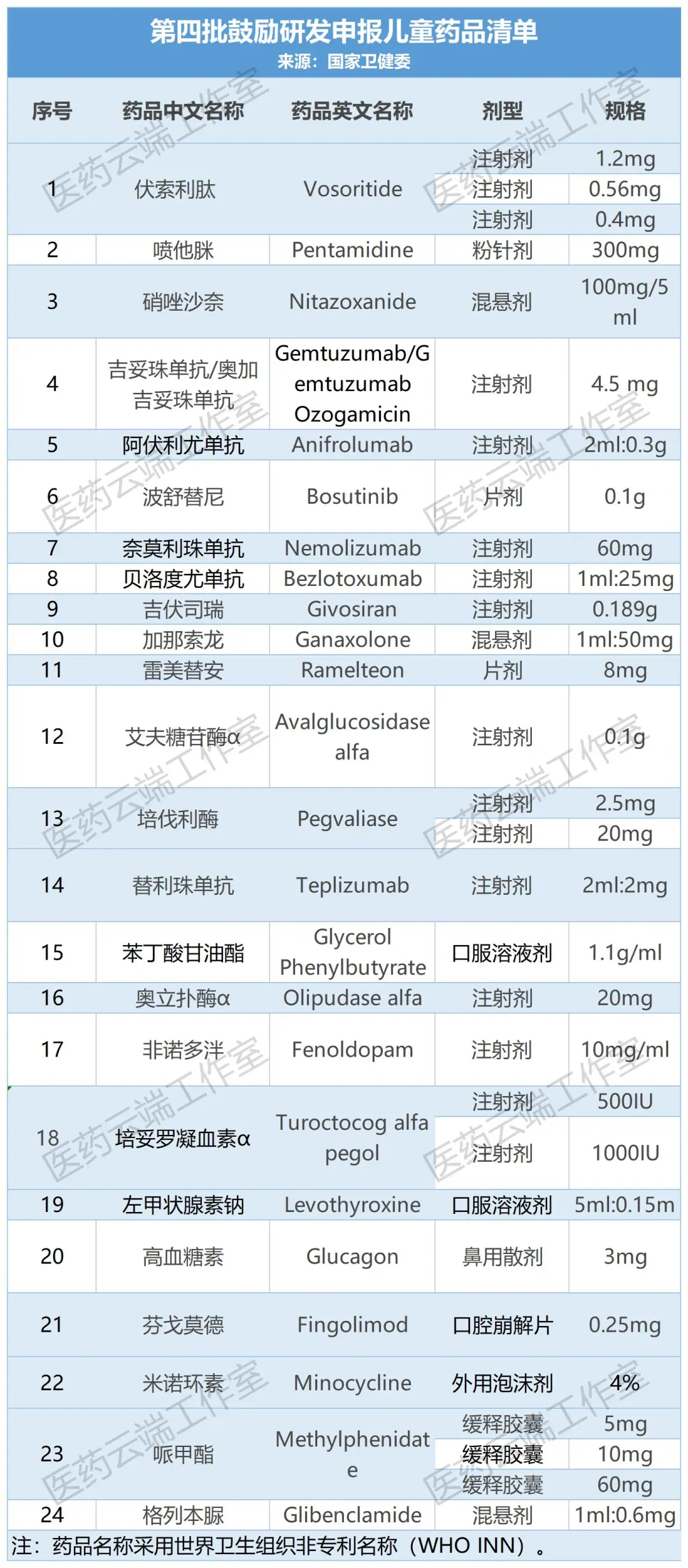
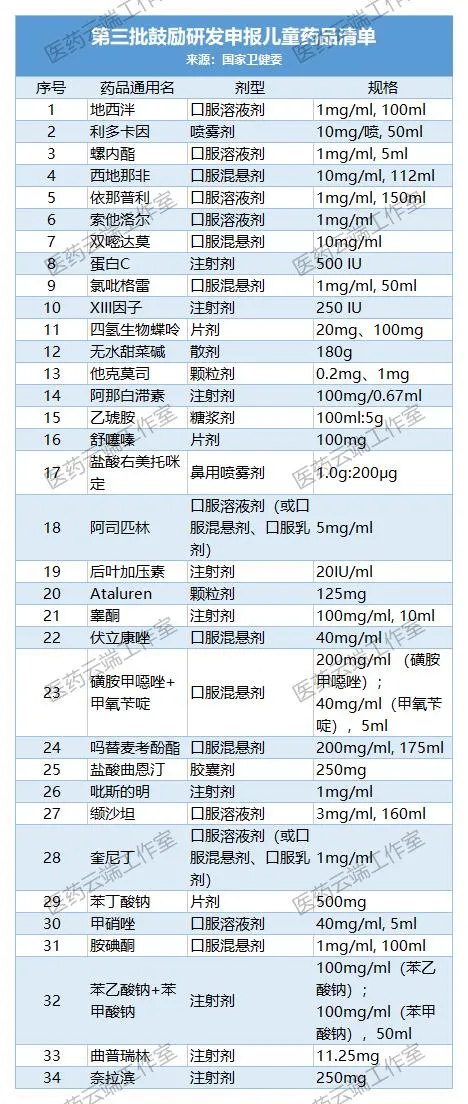
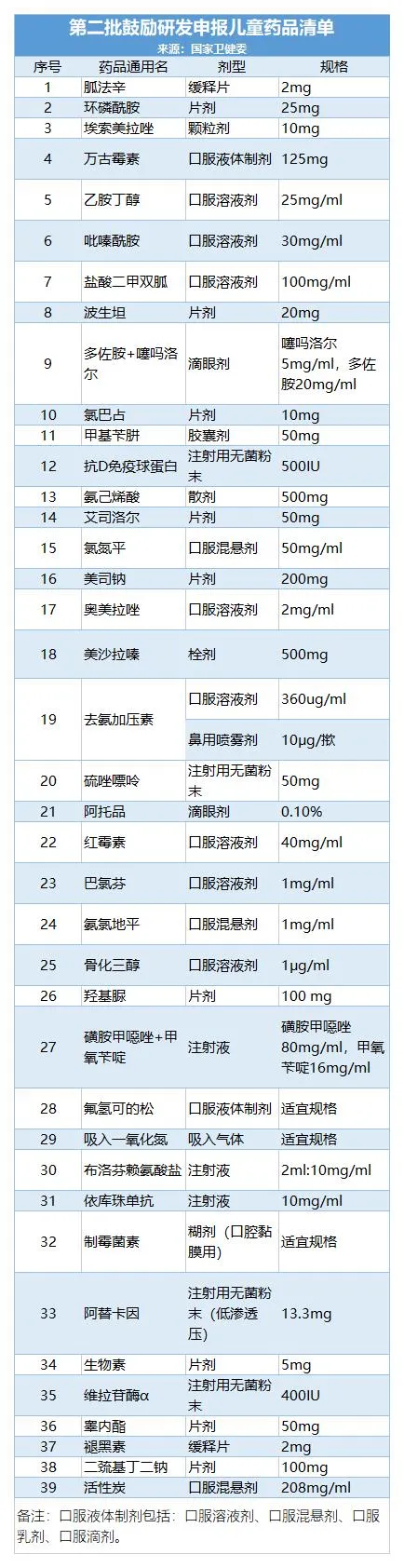
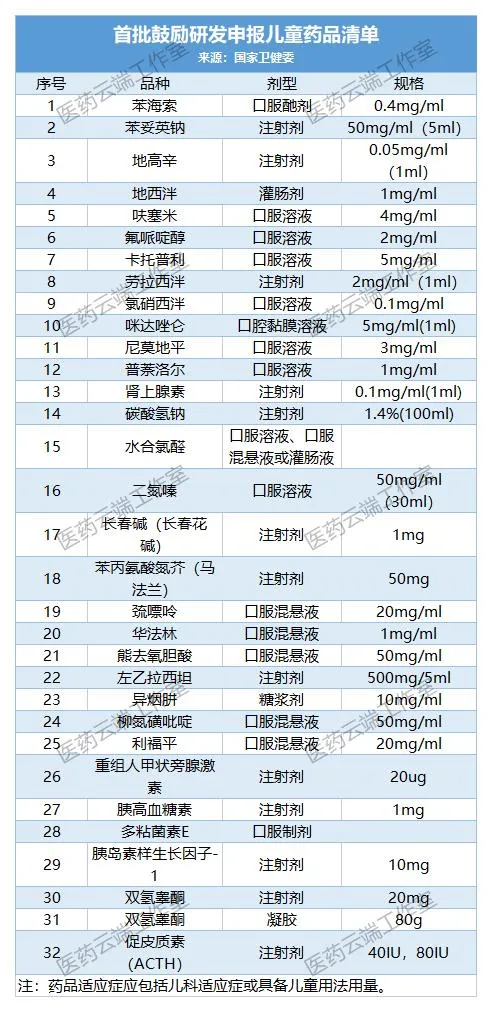
截至今日,我國共公布了四批鼓勵研發申報兒童藥品清單,共129個品種。(1-4批名單附后)
此項清單由國家衛健委會同科技部、工信部、國家醫保局、國家藥監局組織,持續圍繞我國兒童用藥臨床需求以及相關企業研發生產能力遴選制定。
為保障兒童基本用藥需求,促進兒童用藥安全科學合理使用,對于防治兒童疾病、提升兒童健康水平具有重要意義。當前,我國兒童用藥適宜品種少、適宜劑型和規格缺乏、藥物臨床試驗基礎薄弱、不規范處方行為和不合理用藥等問題仍比較突出,亟待采取措施予以解決。
此后,不斷完善兒童藥物政策,包括出臺了鼓勵申報研發兒童藥建議清單制度。至今已經公布四批共129個藥物。此次第五批建議清單在公示后,也會馬上進行正式公布。
2024年1月10日,國家衛健委、發改委、醫保局、藥監局等10部門聯合印發《關于推進兒童醫療衛生服務高質量發展的意見》(國衛醫政發﹝2024﹞1號?),該《意見》明確指出,要補齊兒童用藥短板:
堅持以兒科臨床需求為導向推動藥品生產企業研發,加大對兒童用藥品種及關鍵技術研發的支持力度,補齊兒童藥物適宜劑型、規格不足等短板。加強兒童藥品使用監測,動態調整包括兒童用藥在內的短缺藥品清單和臨床必需易短缺藥品重點監測清單,加強易短缺藥品生產及供應鏈監測預警。深化供應鏈協作,推動兒童藥重點品種原料藥與制劑一體化發展。按照國家規定的已上市藥品說明書增加兒童用藥信息工作程序有關要求,支持符合條件的兒科相關醫療機構按程序提出增加藥品說明書兒童用藥信息的建議。充分運用藥品加快上市注冊程序,對符合兒童生理特征的兒童用藥品予以優先審評審批。
《意見》在兒童藥遴選和配備方面,也對給予了政策支持:
加強醫療機構兒童用藥遴選和配備管理,強化醫師處方、藥師審方、護士給藥及藥品臨床綜合評價等各環節管理,提高合理用藥水平。支持兒科的醫院制劑依法依規在醫聯體內使用,對醫療機構應用傳統工藝配制中藥制劑實施備案管理。
此外,《意見》在完善兒童醫療保障待遇和支付政策方面,也提出諸多醫保政策優惠條件,包括居民醫保慢特病保障、醫保藥品目錄調整向兒童藥傾斜、實施DRG/DIP要考慮兒科因素,優化分組、權重和分值:
有條件的地方可根據經濟社會發展水平、基金承受能力和當地保障需求,將兒童治療周期長、健康損害大、費用負擔重的疾病門診費用納入居民醫保慢性病、特殊疾病保障范圍。醫保目錄調整向兒童用藥予以傾斜。科學制定醫保總額,合理考慮按病種、按床日、按人頭等付費方式中的兒科因素。在開展按疾病診斷相關分組、區域點數法總額預算、按病種分值付費試點時,充分考慮兒科疾病特點,優化疾病分組、權重、分值計算。
遴選兒童用藥(僅限于藥品說明書中有明確兒童適應證和兒童用法用量的藥品)時,可不受“一品兩規”和藥品總品種數限制,進一步拓寬兒童用藥范圍。開展兒科醫療服務的二級以上醫療機構要在本機構藥事管理與藥物治療學委員會下成立兒童用藥工作組。
兒童用藥與基藥、集采中選品種、國談品種類似,成為醫院準入能夠突破一品兩規和醫院總數限制的“特權品種”,足見國家對該類藥物的重視和支持。
國家鼓勵研發的兒童藥物是醫保調整的重點對象之一
此外,納入國家鼓勵研發申報兒童藥品清單的藥物,也是醫保目錄調整重點支持的品類。比如,最新的2023年醫保藥品目錄調整方案中,明確將其納入調整對象,企業可以申報。如下圖所示:

新版基藥目錄調整將有兒童藥的一席之地
據國家衛健委2023年3月21日在其官網公開的《對十三屆全國人大五次會議第1094號建議的答復》內容顯示,新版基藥目錄將考慮兒童藥物的納入,并擬對綜合醫院、兒童專科醫院等加強兒童用藥的遴選購用進行規定,要求醫院對兒童用藥單列目錄,并做好其臨床使用管理。
(一)關于選擇入選兒童基本藥物目錄的藥品。近年來,我委借鑒國際兒童基本藥物目錄經驗,結合我國兒童特點、臨床需求和保障現狀,開展制定兒童基本藥物目錄必要性和可行性研究。在修訂《國家基本藥物目錄管理辦法》中,提出國家基本藥物包括化學藥品和生物制品、中藥和兒童藥品等,已向社會公開征求意見。此外,梳理我國現有兒童藥品信息,組織兒童基本藥物目錄管理機制研究,您所提相關的建議內容也是我委研究論證、分析研判的內容之一。
(二)關于倡議提高“兒童用藥”的臨床地位。我委高度重視兒童藥品的臨床使用。目前,正在研究起草加強兒童用藥臨床管理的相關文件,擬對綜合醫院、兒童專科醫院等加強兒童用藥的遴選購用進行規定,要求醫院對兒童用藥單列目錄,并做好其臨床使用管理。此外,在組織開展兒童基本藥物目錄管理機制研究中,也涉及您提到的工作流程、優先政策等建議內容。
近年來兒童藥領域取得的成就及政策
 附:第1-4批兒童藥清單
附:第1-4批兒童藥清單
相關新聞

復星醫藥:子公司復邁替尼片注冊申請受理
6月6日,復星醫藥公告稱,公司控股子公司上海復星醫藥產業發展有限公司自主研發的復邁替尼片用于治療2歲及2歲以上兒童1型神經纖維瘤病(NF1)相關的叢狀神經纖維瘤(PN)的藥品注冊申請于近日獲國家藥監局受理并已被納入優先審評程序。
9321個小時之前

國家藥監局部署加強醫療器械臨床試驗機構監管
9321個小時之前

在罕見疾病藥物臨床研發中應用去中心化臨床試驗的技術指導原則發布
近日,國家藥監局藥品審評中心(以下簡稱藥審中心)發布《在罕見疾病藥物臨床研發中應用去中心化臨床試驗的技術指導原則》(以下簡稱《指導原則》)。《指導原則》自發布之日起施行。
9366個小時之前

2024年全國藥品抽檢中期工作會召開
9366個小時之前

全國疫苗監管質量管理體系建設工作交流會召開
9366個小時之前













