我國口服復雜制劑市場情況分析 | 研發水平快速提升?國產替代持續推進
發布日期:2022-09-24 閱讀次數:8572 來源:中國食品藥品網
摘要:
目前,我國口服復雜制劑的研發水平已經基本跟上國際步伐,在改良型創新產品的申報上,我國的審評要求更加嚴格。隨著輔料和制劑工藝的快速發展,部分口服復雜制劑的生產比一些難溶藥物的普通口服制劑更易實現量產。
口服固體緩釋制劑
當前,口服固體制劑的創新主要圍繞提高難溶性藥物的口服吸收率展開,如不斷引入納米晶等新技術來豐富口服藥的吸收方式。傳統的口服制劑口腔速崩片制備技術、口服緩控釋技術、口服復方制劑和遮味技術已經難以稱得上“高端”。以緩釋技術為例,國內企業提供的解決方案多種多樣,但在當前的市場環境下具有差異化的技術很難突出。如二甲雙胍緩釋片,青島百洋醫藥、重慶康刻爾制藥在生產中采用了滲透泵技術,但較高的研發和生產成本使其很難在集采中勝出,轉而尋求院外市場。據國家藥監局和國家藥監局藥品審評中心(CDE)有關數據,截至2022年4月初,我國已批準上市緩釋制劑產品908個(按批準文號),處于審評階段的受理號約有4400個。
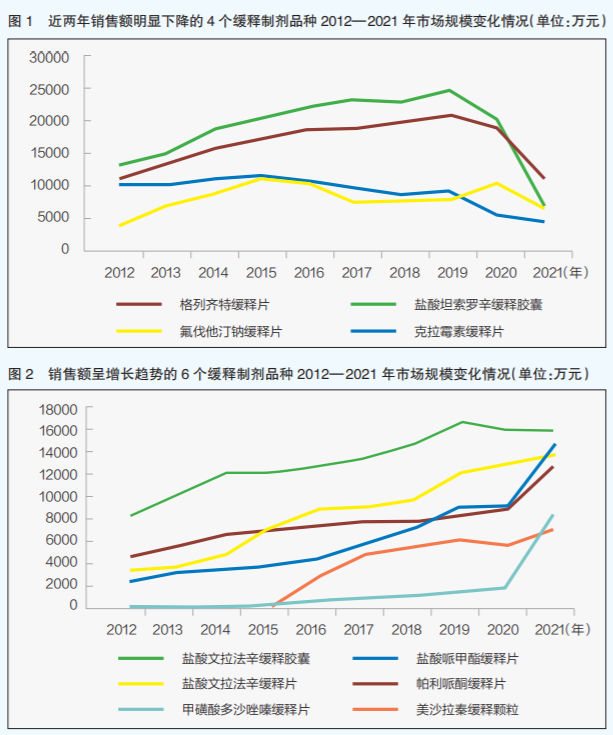
根據樣本醫院數據,目前國內醫藥市場中緩釋制劑重點品種主要包括琥珀酸美托洛爾緩釋片、鹽酸羥考酮緩釋片、非洛地平緩釋片、鹽酸文拉法辛緩釋膠囊、鹽酸哌甲酯緩釋片、帕利哌酮緩釋片、格列齊特緩釋片、單硝酸異山梨酯緩釋片、洛芬待因緩釋片、長春胺緩釋膠囊、頭孢克洛緩釋片(Ⅱ)、甲磺酸多沙唑嗪緩釋片、美沙拉秦緩釋顆粒等20個品種。根據樣本醫院數據測算得到的上述重點品種2021年全國市場規模總和(以下簡稱推總規模)約為180億元,2012—2021年的年復合增長率(CAGR)為5.9%。其中,2021年較2020年增幅趨緩,僅為1.1%,預計2025年前后市場規模將達200億元。在20個重點品種中,琥珀酸美托洛爾緩釋片2021年推總規模最大,為30.14億元;2012—2021年CAGR最高的為甲磺酸多沙唑嗪緩釋片,為115.58%,同時該品種2021年市場規模較2020年增長2.6倍以上;2021年推總規模排在前5名的產品中,鹽酸羥考酮緩釋片、鹽酸文拉法辛緩釋膠囊這兩個品種較2020年略有下降。
樣本醫院數據顯示,近幾年受藥品集采影響,格列齊特緩釋片、鹽酸坦索羅辛緩釋膠囊等品種年銷售額出現大幅下滑(詳見圖1);而鹽酸文拉法辛緩釋膠囊、鹽酸哌甲酯緩釋片等品種年銷售額出現明顯增長(詳見圖2)。
口服控釋制劑
我國對控釋制劑的審批較為嚴格。筆者根據國家藥監局網站數據統計發現,目前在我國獲批上市的控釋制劑品種僅有5個,分別為廣州一品紅、合肥立方、青島百洋、海南先聲、上海現代、南京易亨、北京紅林、拜耳等企業生產的硝苯地平控釋片,意大利Savio Industrial S.r.L.公司生產的卡左雙多巴緩釋片(早期批準時為控釋片),北京中惠、常州四藥生產的硫酸沙丁胺醇控釋片,南京易亨、常州四藥、輝瑞、淄博萬杰、北京紅林等企業生產的格列吡嗪控釋片,廣東百澳生產的鹽酸地爾硫控釋膠囊(180mg、150mg、120mg、90mg)。
從市場競爭格局來看,硝苯地平控釋片市場長期由拜耳的產品主導,現有國產品種所占市場份額不足5%,但近年來新進入藥企正逐漸撬開市場縫隙,未來隨著集采步伐的加快,該產品的主流醫院市場格局有望改變。鹽酸地爾硫控釋膠囊主要由廣東百澳占據國內醫藥市場,但由于該品市場表現一般,后續跟進的企業并不多。對于格列吡嗪控釋片,目前國產品種所占市場份額接近四成,對輝瑞產品的替代步伐正在加快。
據筆者統計,2015年1月至2022年4月,共有9個控釋制劑產品在我國進行不同類型的申請,相關申請(包括仿制申請、進口申請、新藥注冊申請、補充申請等)共70個。其中,60個申請與硝苯地平控釋片、格列吡嗪控釋片有關;越洋醫藥有3個上市申請,均圍繞2.2類控釋產品苯磺酸氨氯地平控釋片開展;拜耳的申請為1類新藥BAY1101042鈉控釋片的上市申請,這是一款新型可溶性鳥甘氨酸環化酶(sGC)激動劑,是通路中關鍵的信號轉導酶,可參與抑制細胞增殖和血小板聚集、舒張血管等一系列生理或病理反應;萬邦德對石杉堿甲控釋片進行了2.2類新藥上市申請;上海漢都對卡左雙多巴控釋片進行了2.2類新藥上市申請;青島百洋對已上市產品鹽酸二甲雙胍控釋片進行了補充申請。
硝苯地平控釋片、格列吡嗪控釋片是當前的競爭熱點。從2012—2021年樣本醫院銷售情況來看,硝苯地平控釋片銷售額穩定上行,格列吡嗪控釋片銷售額整體趨穩但稍有下滑(詳見圖3)。
口服速釋制劑
采用速釋技術的藥品有很多,而口崩片是目前國內該領域的主要代表。2005年以來,我國陸續批準上市的口崩片產品有113個文號80余個品規。其中,凍干口崩片的速釋效果更明顯,部分凍干口崩片產品崩解更快、口感更好,但在與同名稱非凍干口崩片的競爭中難以脫穎而出。
目前口崩片整體市場規模較小,發展高峰時期高端醫院市場推總規模接近5億元,而目前僅有3億元左右。主要原因為該類型產品總體接受程度不高。同時,市場受一兩個產品的銷售波動影響較大。非凍干口崩片長期占據絕大部分的市場份額,近年來,凍干口崩片逐漸被市場接受,但份額增長依舊緩慢。
精神神經類藥物是最容易被市場接受的一類口崩藥物,其中米氮平、氯氮平、利培酮、唑吡坦等表現相對突出。尤其是米氮平口崩片,長期以來在口崩片市場占據較大份額,遠超其他產品(詳見圖4)。這些領先產品的仿制跟進企業不多,從數據上看,自2015年以后口崩產品共有50多個仿制申請被受理。其中,奧氮平有21個,西地那非和阿立哌唑各有8個,是目前口崩產品的仿制熱點。
筆者認為,口崩片尤其是凍干口崩片生產成本較高,因此該類藥物帶來的益處在國內主要被精神神經類疾病治療領域適度接受,在其他領域的應用拓展依然任重道遠。
相關鏈接
創新復雜制劑“擴張”潛力顯現
BCC Research的研究報告顯示,全球創新復雜制劑市場規模將從2020年的2310億美元增長到2025年的3100億美元,2020—2025年的年復合增長率預計為6.1%。按2020年全球醫藥市場規模1.2萬億美元計算(按出廠價統計),創新復雜制劑的銷售收入占全球醫藥市場接近兩成的份額(占比19.25%)。對比2020年全球仿制藥市場規模的4116億美元,以及2020—2025年仿制藥市場規模的年復合增長率9.6%,創新復雜制劑均有所不及。
不過,不同于仿制藥的激烈競爭和迅速迭代,創新復雜制劑品種往往具有較長的生命力。代表性產品有:1989年在美國獲批上市的日本武田制藥注射用醋酸亮丙瑞林微球長效制劑,至今每年銷售額仍有十幾億美元,該產品已從每月使用一次的長效微球發展成為每三個月或六個月使用一次的超長效制劑;由美國Al za公司(后被強生收購)開發并于1995年獲美國食品藥品管理局(FDA)批準上市的Doxil,是全球第一個獲批上市的PEG化長循環脂質體(2003年由西安楊森引入中國市場),取得了長期較好的市場回報;由拜耳開發的硝苯地平滲透泵控釋片也是長盛不衰的經典產品。
如今,創新復雜制劑仍然是延續產品生命力、創造新型市場的利器。根據FDA網站信息,2021年FDA共批準幾十個新型制劑產品。其中,代表性產品之一Fyarro(西羅莫司白蛋白結合型納米顆粒),是西羅莫司的一種新型制劑,被批準用于治療局部晚期不可切除性或轉移性血管周圍上皮樣細胞瘤成人患者;另一個代表性產品Zynrelef緩釋液,是由局部麻醉劑布比卡因和低劑量非甾體類抗炎藥美洛昔康組成的復方固定劑量組合產品,被批準用于提供某些術后長達72小時的疼痛緩解作用。隨著對上市藥物在臨床中應用的反饋和研究,開發新型給藥系統以彌補藥物在臨床使用中缺陷,是當前和未來改良型復雜制劑主要的研究方向,將給企業帶來巨大的市場增長空間。
相關新聞

美歐日醫療器械監管法律制度概覽與思考
2000年,中華人民共和國國務院令第276號公布了《醫療器械監督管理條例》(以下簡稱《條例》),構建了醫療器械法律制度的框架,我國醫療器械走上了依法治理的軌道。此后《條例》歷經多次修訂和修改。2021年施行的新版《條例》貫徹“四個最嚴”要求,全面落實黨中央、國務院關于醫療器械審評審批制度改革精神,為鼓勵醫療器械產業創新高質量發展提供了堅實的法治保障。
9525個小時之前

最暢銷的基因與細胞療法TOP10盤點
2017年是細胞和基因治療領域具有里程碑意義的一年,在這一年里,美國食品和藥品監督管理局(FDA)批準了首款CAR-T細胞療法(Kymriah)上市,還批準了首款AAV基因療法(Luxturna)上市。
9866個小時之前

檢查員說 | 淺談藥物警戒檢查后企業整改常見問題及解決辦法
自2021年12月1日《藥物警戒質量管理規范》(以下簡稱GVP)實施后,截至2023年底,筆者所在的北京市藥品不良反應監測中心針對藥品上市許可持有人開展了107家次GVP符合性檢查。檢查員在督促企業整改過程中,常常發現企業不能一次性完成整改,一些問題不能及時糾正,大大降低了檢查整改工作效率。現對藥物警戒檢查后企業整改后出現的常見問題進行梳理并提出相關建議。
9866個小時之前

降脂“藥王”縮水76億,3款新藥大漲超100%!海正、魯南、京新獨家產品突圍
血脂調節劑是心腦血管系統藥物中重要的品類之一,也是首批被國采盯上的臨床常用藥物。經歷了國采五年時間,該類藥物的市場規模大幅縮水,2020年至今在中國公立醫療機構終端已無百億品種,新上市產品則持續爆發活力。2023年信達生物的托萊西單抗注射液獲批,成為近年來首個上市的血脂調節劑生物藥1類新藥,打破了進口藥獨占市場的局面,君實、康方、恒瑞的PCSK9抑制劑正在沖刺上市,國內血脂調節劑市場又將迎來新局面。
9980個小時之前