CGT產品技術評價體系日趨完善
發布日期:2022-08-30 閱讀次數:12157 來源:中國醫藥報
摘要:
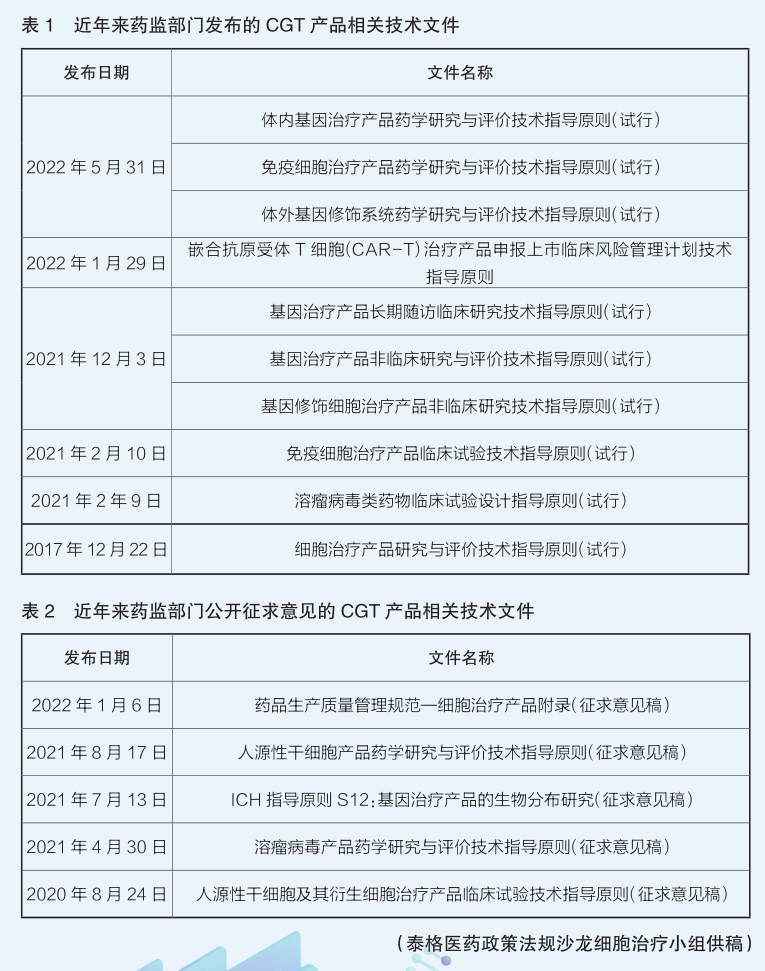
細胞與基因治療產品的技術特征與傳統藥品有顯著區別,無法照搬傳統藥物開發的技術評價思路。讓業界為之振奮的是,我國藥品監管部門對CGT領域也十分重視。2019年4月,國家藥監局啟動了中國藥品監管科學行動計劃,首批研究項目包括“細胞和基因治療產品技術評價與監管體系研究”,該項目通過發布一系列技術指南,建設和完善該領域的技術評價體系。
目前,國家藥監部門已發布多項技術指導原則。比如,2021年12月發布的《基因修飾細胞治療產品非臨床研究技術指導原則(試行)》基于基因修飾細胞治療產品的特點和臨床應用中安全性風險的關注點,框架性地提出了此類產品的非臨床研究目的、非臨床安全性評價策略制定時的主要考慮因素、受試動物、動物種屬/模型選擇等要求。在臨床研究方面,2021年2月發布的《免疫細胞治療產品臨床試驗技術指導原則(試行)》對以在國內注冊上市為目的進行研發和注冊申報的免疫細胞治療產品,在臨床試驗的總體規劃、試驗方案設計、試驗實施和數據分析等方面提供了必要的技術指導。在藥學方面,自2020年下半年起陸續發布了若干技術指導原則,對基因治療產品和細胞治療產品(含人源性干細胞和免疫細胞治療產品)的藥學研發給出較為全面的指導意見。此外,在細胞治療產品的質量管理方面,今年1月向社會公開征求意見的《藥品生產質量管理規范—細胞治療產品附錄(征求意見稿)》基于細胞產品的特殊性,提出企業從供者材料采集和產品生產的全過程應采取特殊控制措施。
這些指導原則的發布,初步搭建了CGT產品臨床研究和審評的技術框架,是建立科學規范的產品評價體系的基礎。隨著生命科學和醫學研究的快速發展,CGT產品已顯示出巨大的應用潛力,有望盡快滿足患者的臨床需求。














