中國藥企出海總體趨勢與挑戰
發布日期:2022-05-30 閱讀次數:12917 來源:BCG波士頓咨詢
摘要:
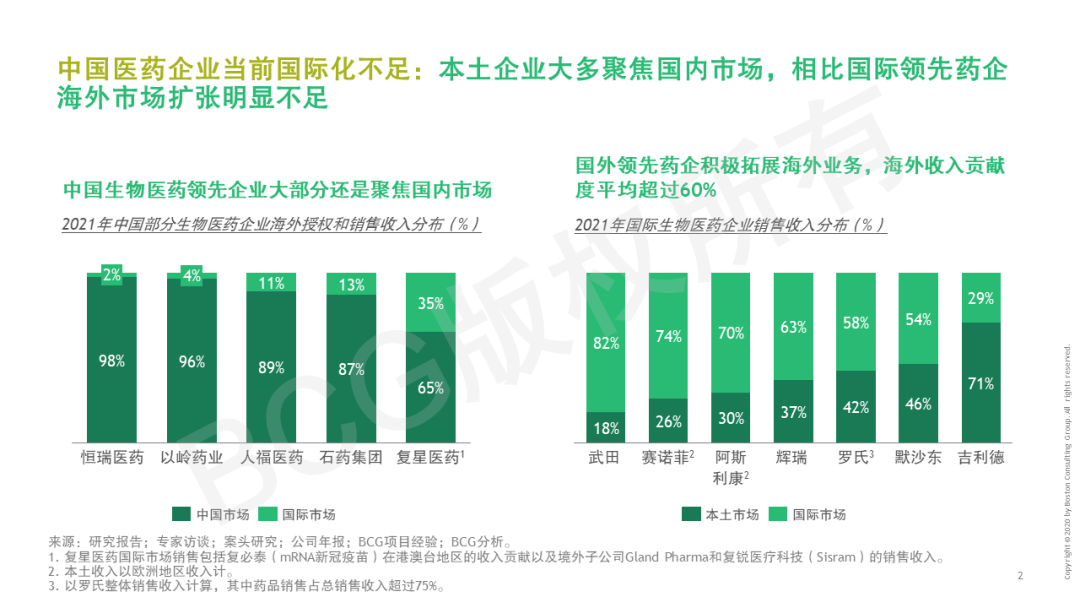
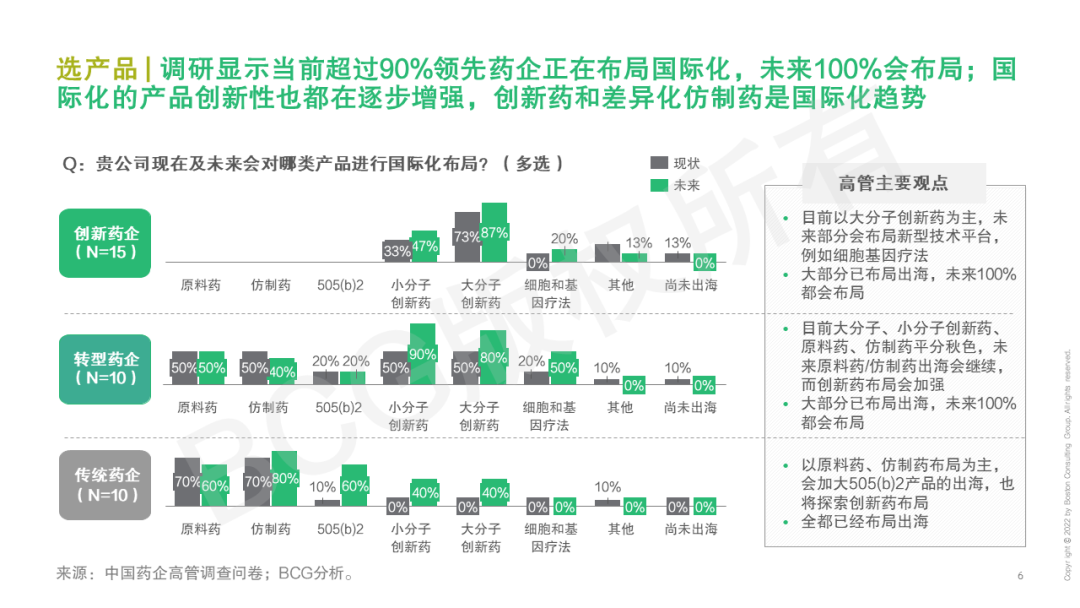
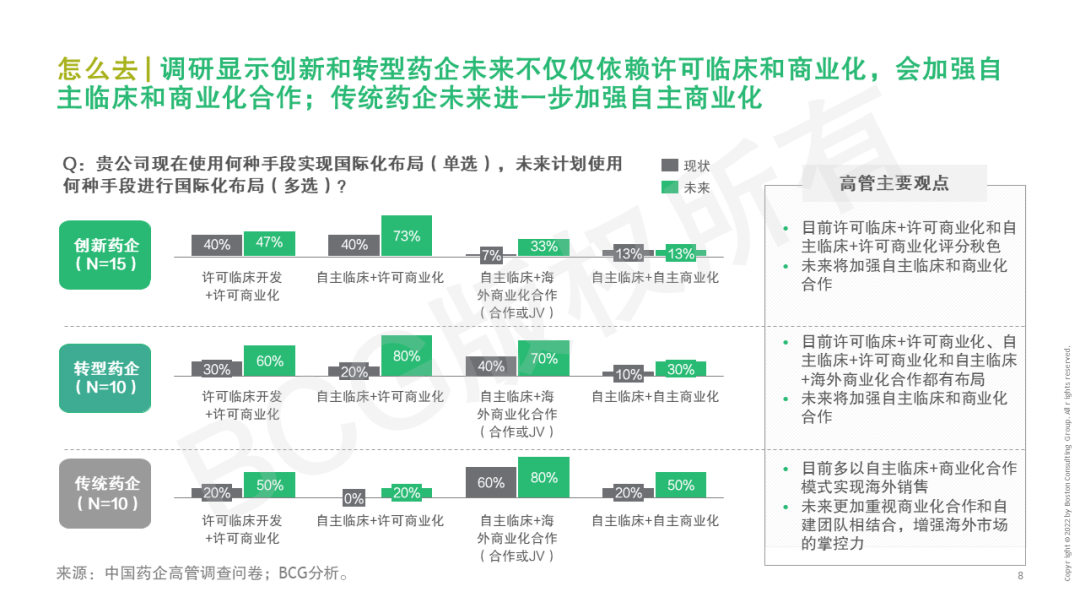
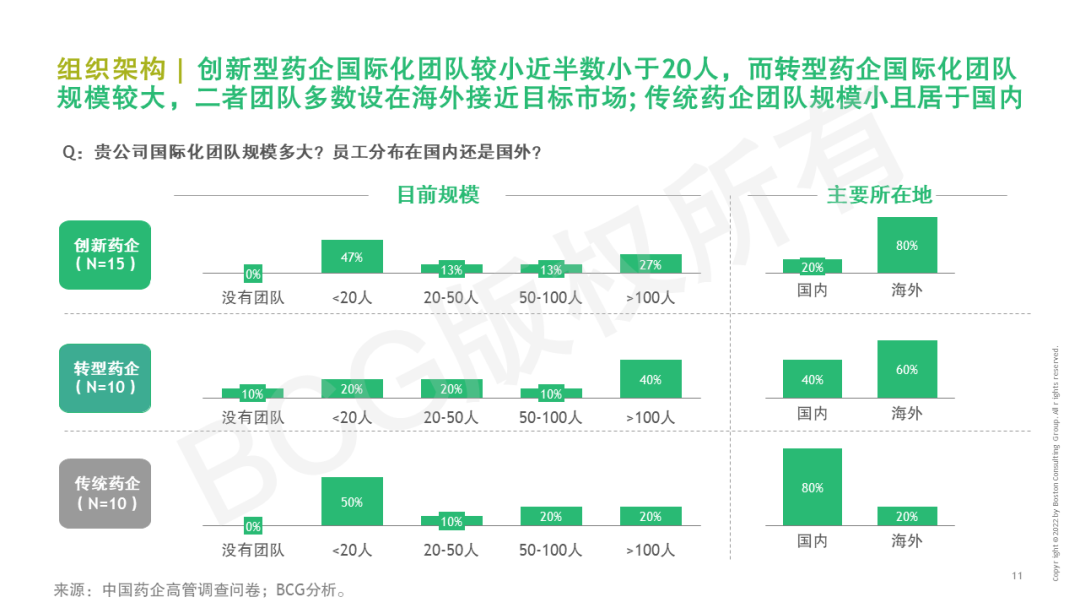
2022年頒布的《“十四五”醫藥工業發展規劃》提出,中國醫藥要不斷走向深層次國際化——醫藥出口額保持增長,培育一批世界知名品牌,形成一批研發生產全球化布局、國際銷售比重高的大型制藥企業。早在21世紀初,我國化學原料藥開始進入國際市場,到仿制藥出海,再到創新藥全球布局,中國醫藥企業們已在探索國際化的道路。產品國際化也成為藥企尋求“第二發展曲線”的核心關注。但當前國內領先藥企的海外市場收入占比仍較低,一些新藥項目海外闖關受挫,國際化道路任重而道遠。不過,短期的困境并不代表海外市場拒中國藥企于千里之外,惟其磨礪、始得玉成。當下的困境更是對企業技術實力、應變決策、堅韌意志的考驗與歷練,直面挑戰、脫穎而出的中國力量或將引領新一波的藥企國際化浪潮。 中國醫藥國際化目前的痛點是什么?創新藥和仿制藥國際化現在處于什么階段?有哪些出海的成功模式可供借鑒?BCG成立中國醫藥國際化專項課題組,對中國藥企高管展開調研,結合行業數據分析和國內外案例研究,深入探討中國醫藥全球化課題。本系列將發布五篇文章,分別就國際化總體趨勢與挑戰、創新藥出海動因和趨勢、創新藥出海模式、仿制藥動因和趨勢、出海需具備的組織和能力五個子話題分別展開。本文為開篇之作,基于中國藥企高管調研結果,分享中國藥企出海趨勢與挑戰。










相關新聞

美歐日醫療器械監管法律制度概覽與思考
2000年,中華人民共和國國務院令第276號公布了《醫療器械監督管理條例》(以下簡稱《條例》),構建了醫療器械法律制度的框架,我國醫療器械走上了依法治理的軌道。此后《條例》歷經多次修訂和修改。2021年施行的新版《條例》貫徹“四個最嚴”要求,全面落實黨中央、國務院關于醫療器械審評審批制度改革精神,為鼓勵醫療器械產業創新高質量發展提供了堅實的法治保障。
9531個小時之前

最暢銷的基因與細胞療法TOP10盤點
2017年是細胞和基因治療領域具有里程碑意義的一年,在這一年里,美國食品和藥品監督管理局(FDA)批準了首款CAR-T細胞療法(Kymriah)上市,還批準了首款AAV基因療法(Luxturna)上市。
9872個小時之前

檢查員說 | 淺談藥物警戒檢查后企業整改常見問題及解決辦法
自2021年12月1日《藥物警戒質量管理規范》(以下簡稱GVP)實施后,截至2023年底,筆者所在的北京市藥品不良反應監測中心針對藥品上市許可持有人開展了107家次GVP符合性檢查。檢查員在督促企業整改過程中,常常發現企業不能一次性完成整改,一些問題不能及時糾正,大大降低了檢查整改工作效率。現對藥物警戒檢查后企業整改后出現的常見問題進行梳理并提出相關建議。
9872個小時之前

降脂“藥王”縮水76億,3款新藥大漲超100%!海正、魯南、京新獨家產品突圍
血脂調節劑是心腦血管系統藥物中重要的品類之一,也是首批被國采盯上的臨床常用藥物。經歷了國采五年時間,該類藥物的市場規模大幅縮水,2020年至今在中國公立醫療機構終端已無百億品種,新上市產品則持續爆發活力。2023年信達生物的托萊西單抗注射液獲批,成為近年來首個上市的血脂調節劑生物藥1類新藥,打破了進口藥獨占市場的局面,君實、康方、恒瑞的PCSK9抑制劑正在沖刺上市,國內血脂調節劑市場又將迎來新局面。
9985個小時之前













