國家藥品抽檢年報(2021)
發布日期:2022-03-21 閱讀次數:11971 來源:中國食品藥品檢定研究院網站
摘要:
為貫徹落實《中華人民共和國藥品管理法》和《中華人民共和國疫苗管理法》,2021年,國家藥監局根據《藥品質量抽查檢驗管理辦法》等有關要求,以習近平總書記“四個最嚴”為根本指南,堅持問題導向和風險控制原則,組織各省級藥品管理部門與相關檢驗機構,在全國范圍內對部分生產、經營、使用、進口等環節的藥品質量開展抽查檢驗工作,評估上市后藥品的質量狀況,打擊制售假劣藥品行為。通過加強頂層制度體系構建,整合抽檢資源、以信息化引領監管現代化,不斷促進抽檢成果運用向縱深推進,積極提升服務藥品監管效能。2021年國家藥品抽檢結果顯示,當前我國藥品安全形勢總體平穩可控,藥品質量持續保持在較高水平。
一、概述
藥品抽檢作為藥品上市后監管的重要手段之一,是實現風險管理、科學監管的重要技術支撐。多年來,在打擊違法違規行為、震懾不法企業、評價藥品質量狀況、提升行業標準、警示公眾用藥安全、服務智慧監管等方面發揮著重要作用。
國家藥品抽檢作為一個全國上下聯動的協作項目,由國家藥品監督管理部門統籌組織,采取“分散抽樣、集中檢驗、探索研究、綜合評價”的工作模式。2021年,國家藥監局進一步優化品種遴選機制,聚焦群眾關切,重點遴選臨床使用量大、日常監管發現問題多的品種,同時配合基本藥物、集中采購、進口檢驗等國家重大醫藥政策制定抽檢計劃及實施方案。在抽樣環節采取分級抽樣模式,由各省級藥品監管部門組成的組織管理和監管保障體系,由全國31 個省(自治區、直轄市)和新疆生產建設兵團負責抽取樣品;在檢驗研究環節遵循依標準檢驗和探索性研究并重的模式,由中國食品藥品檢定研究院等47個承檢機構組成的技術支撐體系,對抽檢樣品進行深度“體檢”,并緊盯突出問題,結合監管需求開展有針對性的探索性研究,不斷提升探索性研究與風險挖掘的準確性,建立以問題為導向的質量分析研究體系,揭示可能存在的質量安全隱患,提升抽檢服務監管的效能;同時完善風險分級防控機制,對發現的問題隨時報告、隨時研判、隨時處置。目前已逐漸構建了基于全國藥品抽檢信息平臺的智慧化信息管理系統,實現全過程實時動態管理,保障整個國家藥品抽檢政策的執行流程清晰明確。
2021年國家藥品抽檢共完成139個品種17856批次制劑產品與中藥飲片的抽檢任務,樣品來源涉及3684家藥品生產、經營企業和使用單位,覆蓋境內31個省區市和新疆生產建設兵團,由47個藥品檢驗機構承擔檢驗和探索性研究任務。對檢出的70批次不符合規定產品,國家藥監局組織各省級藥品監管部門采取相應的風險控制措施。
針對探索性研究發現的問題線索,國家藥監局在風險分析研判的基礎上,實施以“檢監結合”為重點的分級監管。對可能存在安全隱患的產品,及時部署采取相應的風險控制措施;對個別涉嫌存在違法違規問題的企業,組織監管部門開展現場檢查;對一般性問題,采取風險提示等措施督促相關企業排查整改。
二、抽檢數據分析
(一)抽樣情況
2021年國家藥品抽檢共抽取制劑產品與中藥飲片品種139個,包括化學藥品81個、中成藥46個、中藥飲片9個、生物制品3個,其中國家基本藥物品種53個;共抽檢樣品17856批次,包括生產環節3965批次、經營環節12409批次、使用環節1250批次和口岸環節232批次(見圖1),涉及1113家藥品生產企業、2085家藥品經營企業和486家藥品使用單位,各省(區、市)樣品抽取情況以及所抽取樣品的標示生產企業所在地區抽樣分布情況,分別見圖2與圖3。
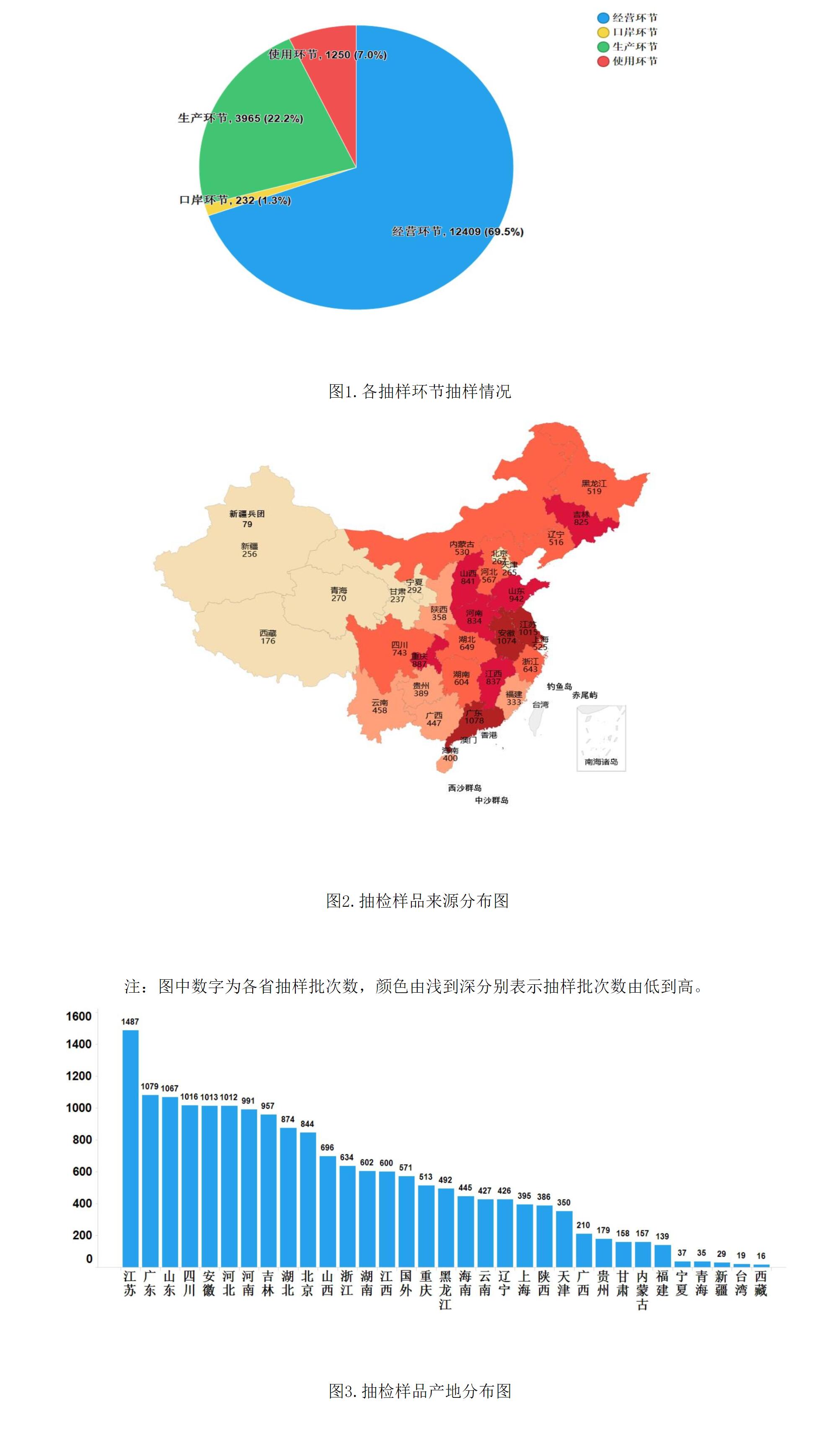
(二)藥品制劑抽檢數據分析
2021年國家藥品抽檢共抽檢制劑產品15899批次。經檢驗,15861批次產品符合規定,38批次產品不符合規定。抽檢的130個品種中,全部樣品符合規定的制劑產品有108個,共12419批次。其中,化學藥品有70個品種7674批次,中成藥有35個品種4681批次,生物制品有3個品種64批次。
1. 化學藥品
2021年國家藥品抽檢共抽檢化學藥品81個品種9455批次,涉及生產環節1769批次、經營環節6577批次、使用環節877批次、口岸環節232批次。經檢驗,不符合規定18批次,在生產、經營、使用、口岸環節分別檢出不符合規定產品2批次、16批次、0批次和0批次,分別占對應環節全部樣品的0.1%、0.2%、0.0%、0.0%(見圖4)。
2021年國家藥品抽檢共涉及16個劑型,共有5個劑型存在不符合規定產品。其中,片劑(7批次)、膠囊劑(6批次)、乳膏劑(3批次)、眼用制劑(1批次)、口服溶液劑(1批次),分別占對應劑型全部樣品批次的0.2%、0.6%、1.4%、0.5%、0.6%(見圖5)。
不符合規定項目包括性狀、鑒別、檢查和含量測定,不符合規定產品數量依次為1、4、14和2批次,分別占全部不符合規定項目的4.8%、19.0%、66.7%和9.5%(見圖6)。
抽檢數據顯示,經營環節出現不符合規定情況高于生產環節,不符合規定項目中檢查項占比最大,涉及“有關物質”、“溶出度”等檢驗項目,不符合規定原因主要與生產工藝中壓片強度、原輔料混合程度、運輸儲存過程中的溫度影響等相關因素有關。
抽檢結果提示,生產企業應嚴格原料入廠檢驗,提高生產工藝穩定性、優化關鍵質量參數控制,重點關注乳膏劑、口服溶液劑等劑型品種,對檢查項目及檢驗指標反映的問題予以深入研究;經營企業應加強藥品儲存、運輸過程管理,完善溫濕度監控體系,重點關注需要陰涼、冷藏儲存等特殊條件保存的藥品;建議監管部門嚴格審查企業批生產記錄,核查原輔料投料量,推動質量標準提升。
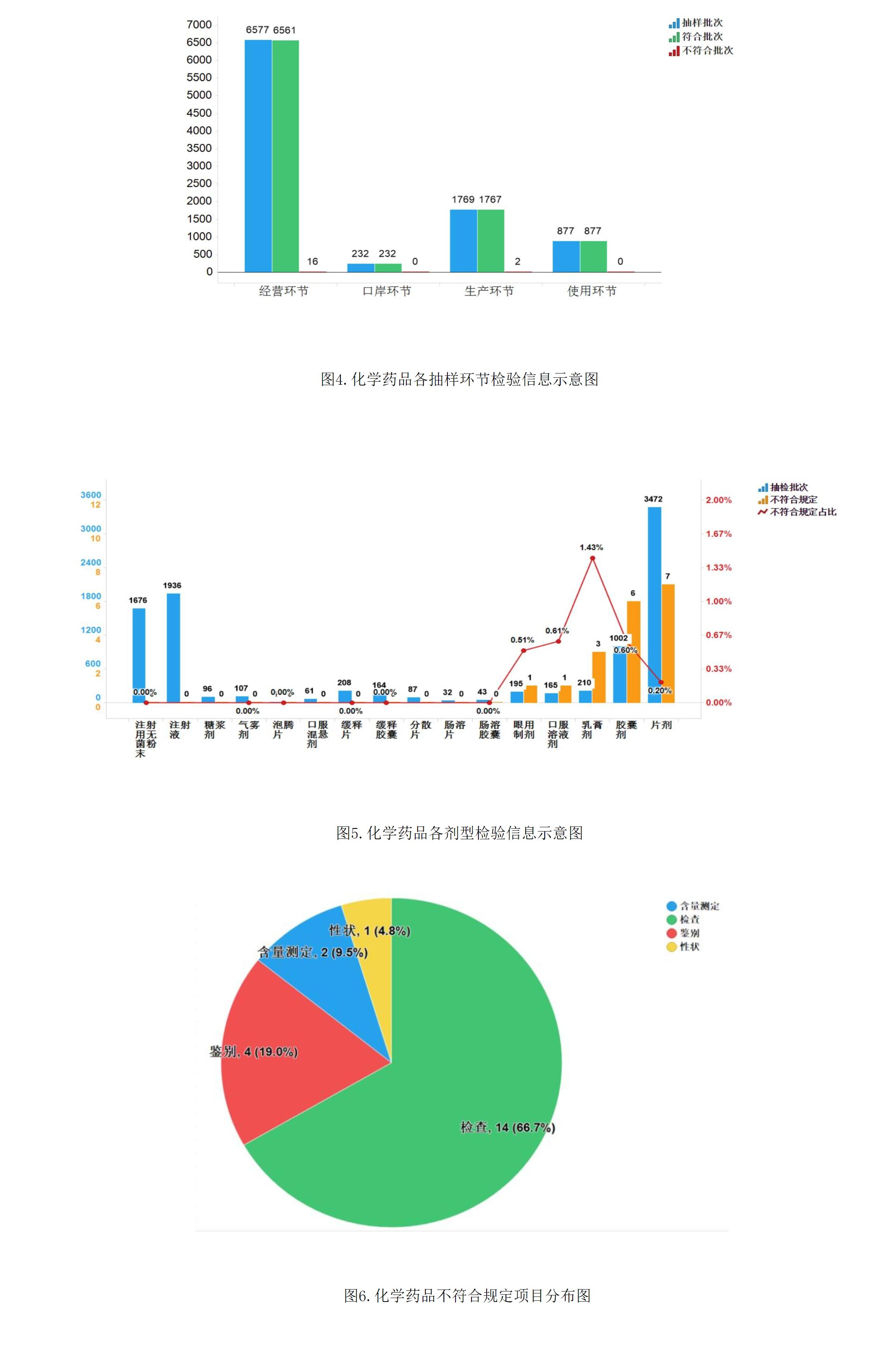
注:某些不符合規定產品涉及多個不符合規定項目。
2. 中成藥
2021年國家藥品抽檢共抽檢中成藥46個品種6380批次,涉及9個劑型,在生產、經營和使用環節各抽取樣品1417批次、4914批次、49批次。經檢驗,符合規定6360批次,不符合規定20批次,分別在生產與經營環節檢出不符合規定產品2批次和18批次,分別占對應環節全部樣品的0.1%和0.4%(見圖7)。
不符合規定項目主要涉及鑒別、檢查、含量測定等,不符合規定樣品批次依次為9批次、7批次和4批次,分別占全部不符合規定項目的45.0%、35.0%和20.0%(見圖8)。
不符合規定產品主要涉及6個劑型,包括散劑(8批次)、貼膏劑(4批次)、膠囊劑(3批次)、丸劑(2批次)、糖漿劑(2批次)、片劑(1批次),分別占對應劑型全部樣品的5.8%、0.5%、0.2%、0.2%、0.4%、0.1%(見圖9)。其中散劑不符合規定批次占比最高,不符合規定項目為鑒別項。
抽檢結果提示,藥品生產企業應強化主體責任意識,嚴把原藥材質量關,從源頭提高產品投料用原料藥材的質量,加強工藝參數優化,嚴格按照工藝規程生產,提高產品質量的均一性和穩定性。
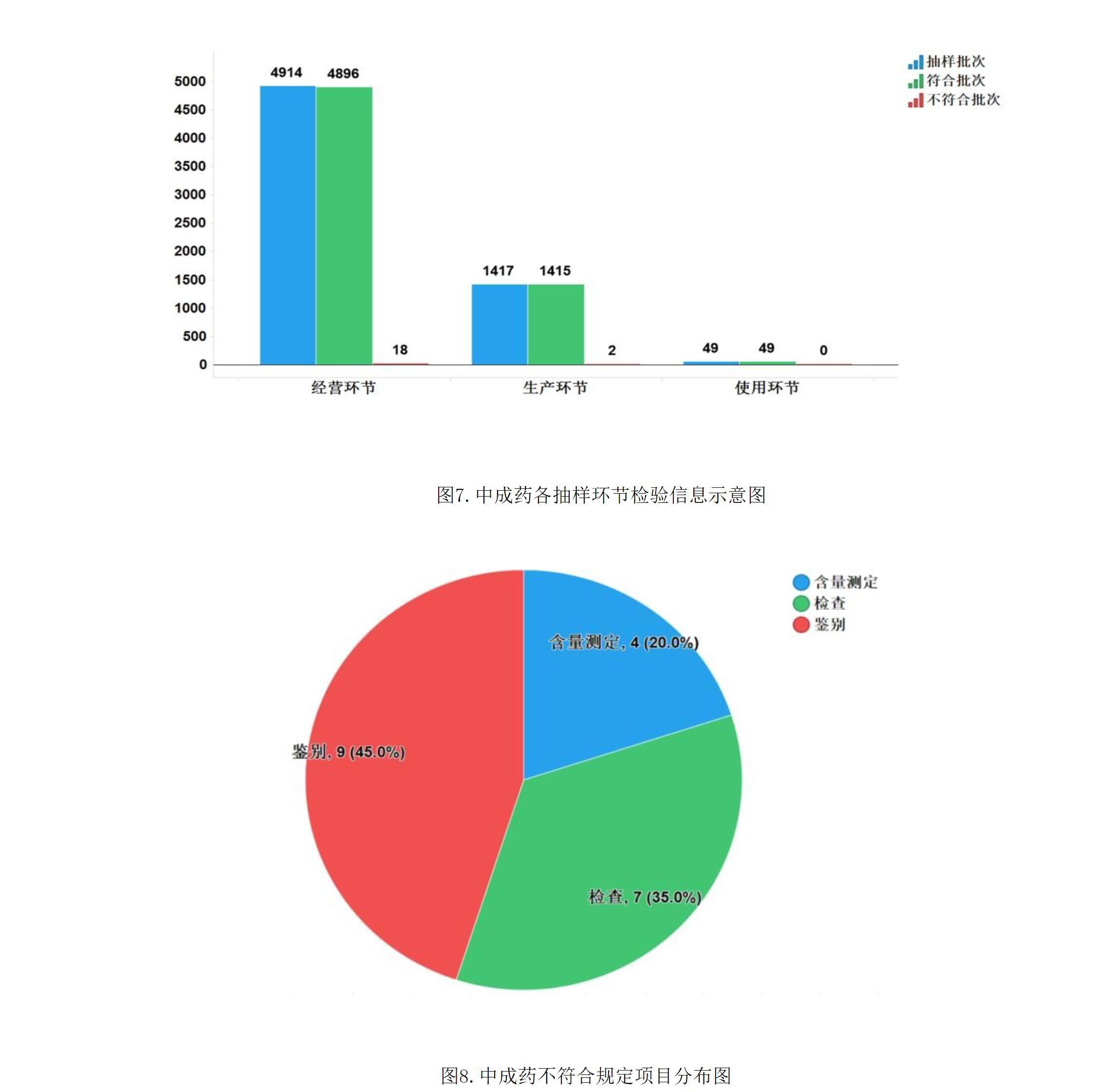
注:某些不符合規定產品涉及多個不符合規定項目。
3. 生物制品
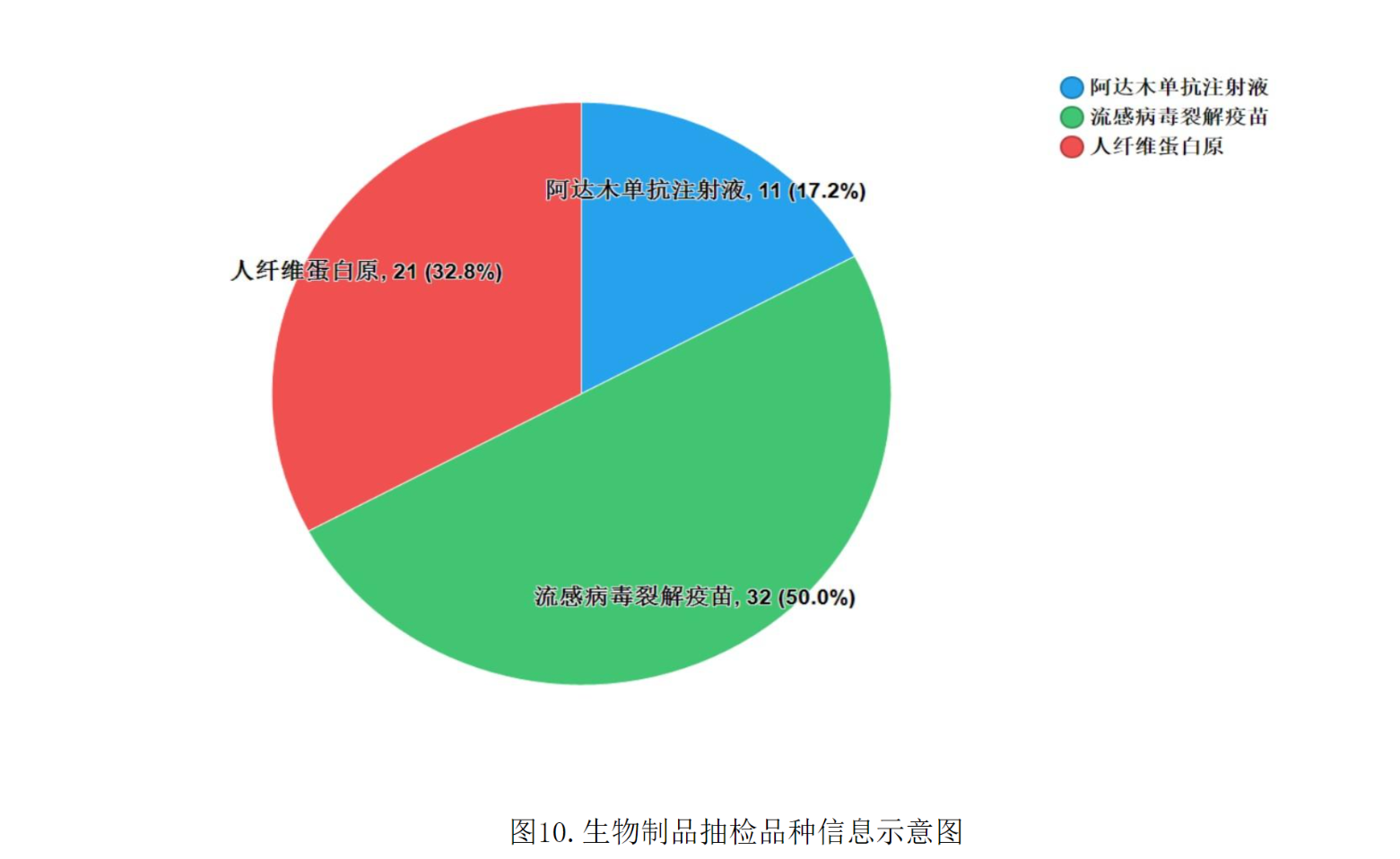
2021年國家藥品抽檢共抽檢生物制品3個品種64批次,其中生產、經營、使用環節分別抽取43批次、20批次、1批次。涉及治療類品種2個,預防類品種1個,劑型均為注射劑(見圖10)。經檢驗,所檢項目均符合規定,合格率為100%。
4. 國家基本藥物
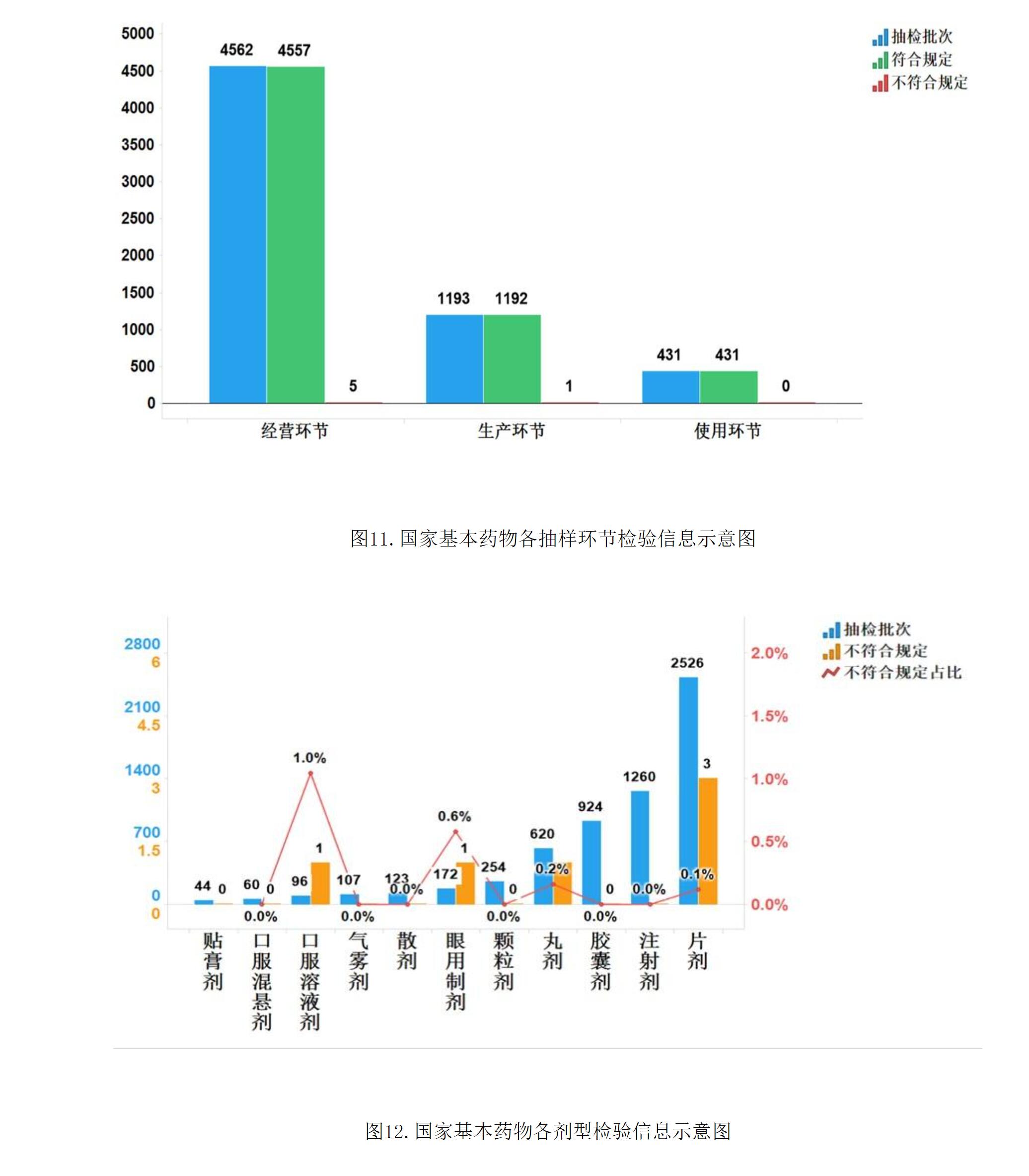
2021年國家藥品抽檢共抽檢基本藥物(不含中藥飲片)44個品種6186批次,在生產、經營和使用環節各抽取樣品1193批次、4562批次和431批次。經檢驗,不符合規定6批次,分別在生產與經營環節檢出不符合規定產品1批次和5批次,涉及4個劑型。抽檢結果顯示,國家基本藥物整體質量狀況較好(見圖11、12)。
5.進口藥品(不含進口中藥材)
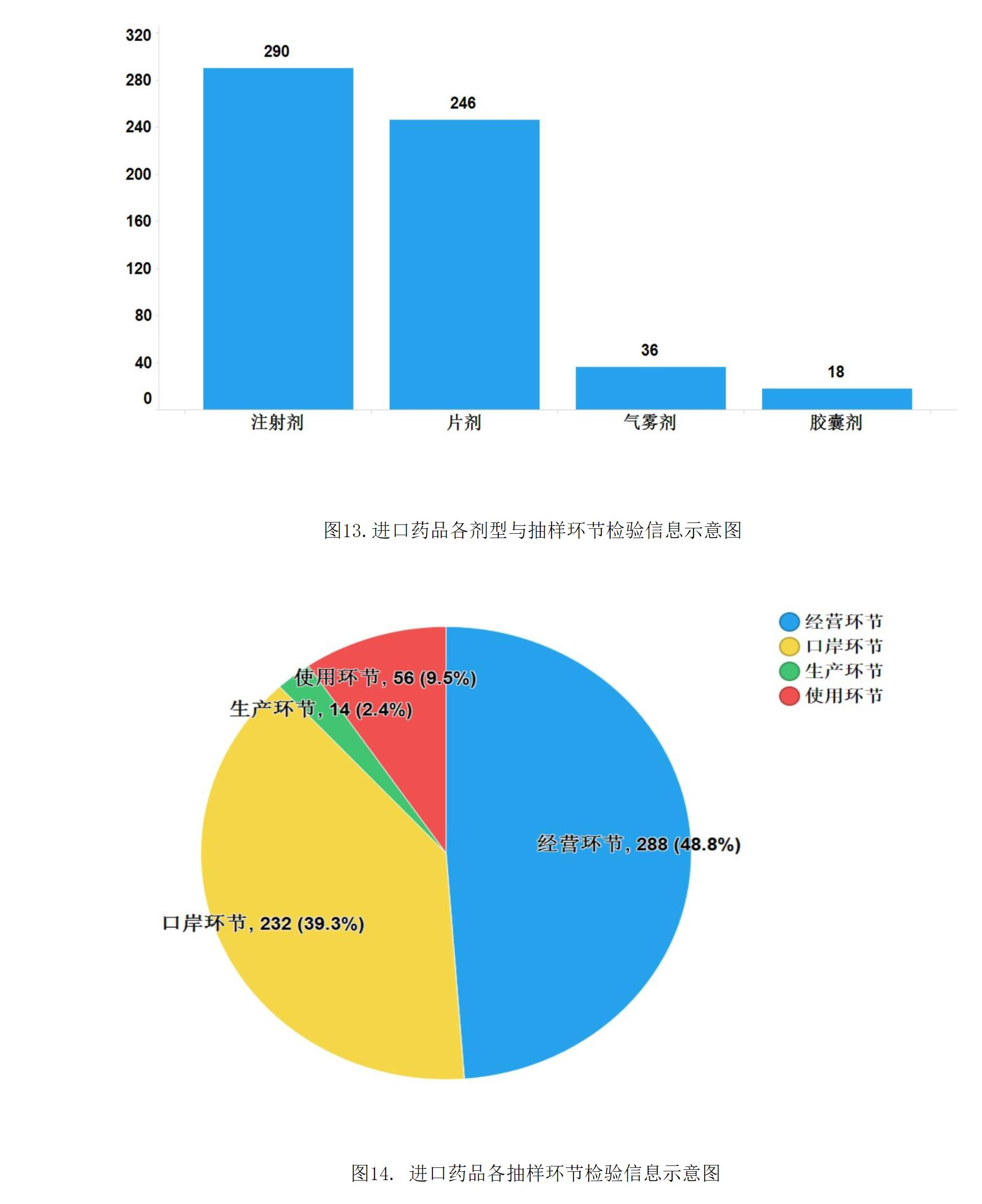
2021年,國家藥品抽檢共抽檢進口藥品590批次,涉及4個劑型(見圖13),其中口岸環節232批次、生產環節14批次、經營環節288批次、使用環節56批次(見圖14)。經檢驗,所檢項目均符合規定,合格率為100%。
(三)中藥飲片專項抽檢及中藥材質量監測情況
2021年,為貫徹落實《中華人民共和國藥品管理法》和《中華人民共和國中醫藥法》,國家藥監局組織開展了中藥飲片專項抽檢及中藥材質量監測工作,組織對部分藥品生產企業、藥材市場集散地或種植集中區的中藥材質量進行監測。
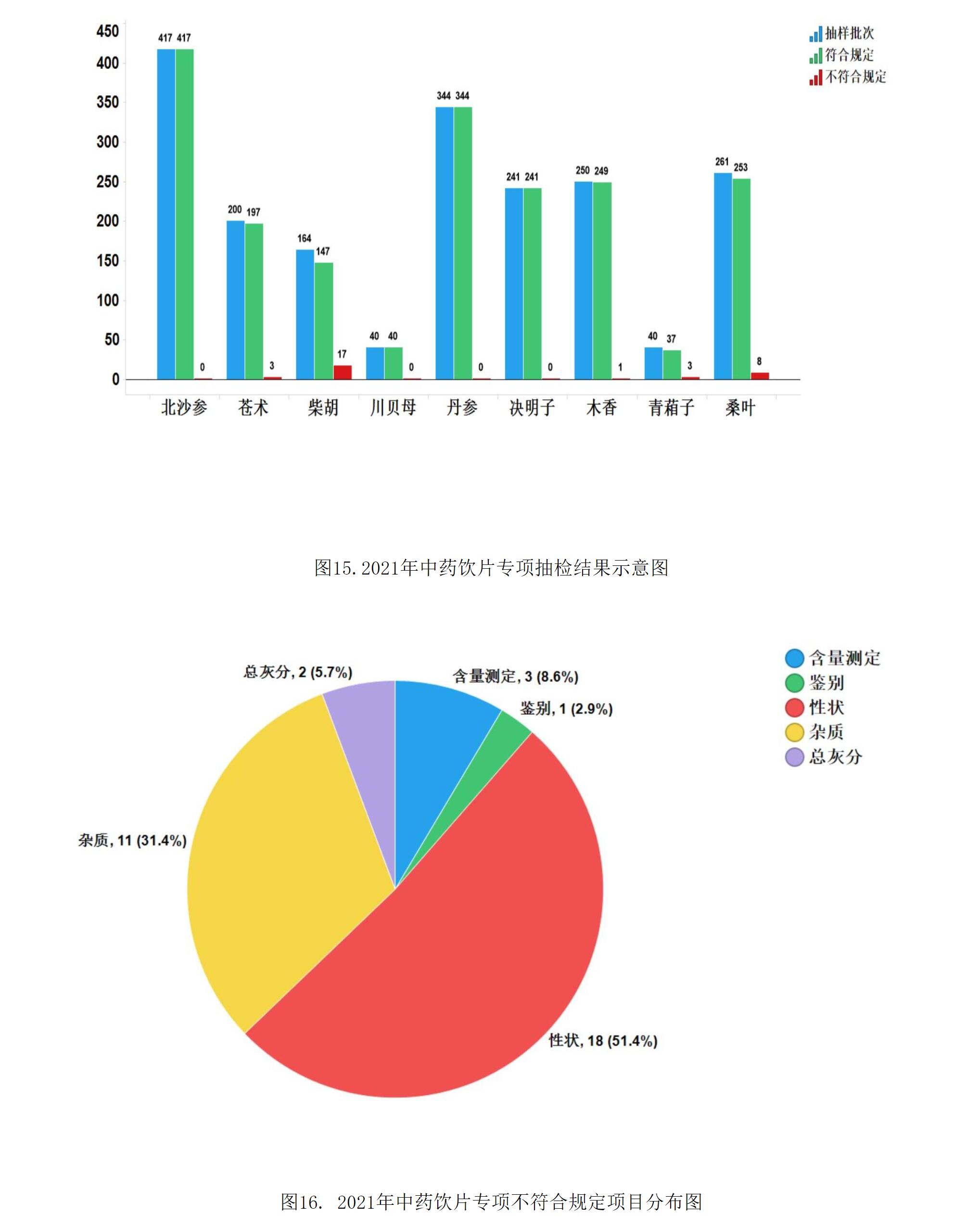
2021年中藥飲片專項抽檢共抽檢9個中藥飲片品種1957批次,主要針對中藥飲片的安全性方面(如摻假摻偽、違法染色),以及質量控制(如生產規范性、專屬性、二氧化硫、重金屬及農殘)等方面開展檢驗和探索性研究。經檢驗,符合規定1925批次,不符合規定32批次(見圖15)。不符合規定項目主要涉及總灰分(2批次)、性狀(18批次)、雜質(11批次)、鑒別(1批次)和含量測定(3批次)等方面,分別占全部不符合規定項目的5.7%、51.4%、31.4%、2.9%和8.6%(見圖16)。2021年中藥材質量監測共抽取9個品種378批次樣品,其中,藥品生產企業264批次,市場集散地或種植集中區114批次。所有樣品按照不同品種特點,針對相應項目進行了研究性檢驗,主要針對摻雜摻偽、加工炮制規范、農藥殘留、植物生長調節劑使用等問題開展。
2021年中藥飲片專項抽檢及中藥材質量監測發現的主要問題有:一是混偽品代用、摻雜問題,如藏柴胡冒充柴胡、關蒼術及雜交蒼術摻偽冒充蒼術、莧菜子摻偽青葙子等;二是外源性有害物質殘留超限問題,部分原料存在真菌毒素污染、農藥殘留污染、重金屬及有害元素超標等隱患,如個別批次蒼術、木香重金屬殘留,個別北沙參檢出植物生長調節劑;三是采收加工與加工炮制不規范問題,如蒼術由于產地加工泥土去除不完全,個別樣品總灰分超過標準限度,柴胡飲片加工過程中地上莖過多導致非藥用部位雜質超標。
抽檢結果及監測結果提示,我國中藥材及飲片總體質量狀況良好。中藥飲片生產企業應提高質量控制意識,嚴格遵照質量標準及炮制規范要求執行;應重視中藥材種植源頭控制質量安全問題,規范種植并加強生產各環節質量管理,加強對藥材采收后、飲片炮制加工前的藥材供貨商環節的質量把控,重視貯存環節管理,重點關注摻偽、有害物質殘留等問題;加強藥材溯源管理,督促藥品生產企業強化質量管理意識;強化藥材市場監測,建立健全藥材質量長效監測機制,保證藥材流通質量。
注:某些不符合規定產品涉及多個不符合規定項目。
(四)探索性研究
2021年,各藥品檢驗機構在按照現行法定標準檢驗的基礎上,圍繞抽檢品種可能存在的安全性、有效性問題,開展有針對性的探索性研究,發現的主要問題有:
一是個別企業違法違規生產問題仍然存在,如擅自改變生產工藝,低限或使用摻偽、替代品投料,違反關鍵工藝制法,擅自改變或添加輔料、防腐劑和抑菌劑等;二是不同廠家因原料藥質量差異、生產工藝不穩定等原因,導致產品均一性較差;三是中藥飲片混用摻偽問題,如使用質量低劣、摻偽的中藥材及飲片生產中藥成方制劑;四是外源性污染物超限,部分品種重金屬、農藥、防腐劑殘留量超限;五是包裝材料相容性問題影響產品質量穩定性。
三、抽檢結果應用
藥品抽檢是藥品上市后監管的主要技術手段,也是實現科學監管、智慧監管的重要技術支撐。2021年,隨著國家藥品抽檢制度體系的不斷優化創新,國家藥品抽檢的風險防控能力不斷提升、風險防控關口不斷前移。藥品監管部門充分利用國家藥品抽檢結果,通過有效識別風險、多措并舉打出監檢結合“組合拳”,在震懾不法企業、打擊違法違規、提升藥品質量、以及評價藥品質量狀況、警示公眾用藥安全等方面發揮了重要作用,正逐步從服務監管的技術手段向服務監管、服務產業、服務公眾的多維度技術支撐方向擴展。
(一)維持震懾—牢守安全底線
多年來,國家藥品抽檢通過一定覆蓋面的抽檢規模,對不合格產品查控和信息公開、對風險線索核查處置,對藥品從業主體形成了強烈震懾,強化了藥品全生命周期和全過程質量控制的意識。
2018~2021年,國家藥品抽檢總合格率呈穩步上升趨勢,公眾用藥安全得到有效保障。除生物制品每年合格率均在100%以外,各類別(化學藥品、中成藥、中藥飲片)合格率也都保持上升趨勢。例如中藥飲片,國家藥品抽檢總合格率從2017年的89.7%,提升至2021年的98.4%,隨著持續加強中藥飲片專項抽檢及信息公開監管力度加大,產業存在趨向優勢集中的態勢。
近五年來,通過抽檢等監管舉措的不斷實施和強化,藥品質量總體安全形勢平穩可控,藥品質量處于較高水平,市場環境持續向上向好,藥品抽檢對守住我國藥品質量安全底線至關重要。
(二)深入排查—查控假劣藥品
2021年,國家藥監局依照“風險控制-依法處置-排查原因并整改-信息公開”的監管模式,確保風險關閉、警示用藥安全。組織各省級藥品監管部門對國家藥品抽檢發現的70批次不符合規定產品,在第一時間采取了查封扣押、暫停銷售使用、要求企業主動召回等風險控制措施;對涉及的相關企業和單位均依法組織查處;同時要求藥品生產企業認真排查,督促其查找問題原因并切實整改,確保質量安全隱患得到及時有效清除。通過藥品抽檢嚴厲打擊了制售假劣藥品的行為,發揮了震懾不法企業、凈化市場環境的作用。此外,國家藥監局在2021年共發布藥品補充檢驗方法12個,為打擊隱蔽性極強的摻雜摻假等違法行為提供了監管利器,也為企業提供了保障藥品質量安全的科學依據。
(三)監檢結合—打擊違法違規
根據國家藥品抽檢探索性研究結果發現的風險線索,對經檢驗合格但涉嫌存在違法違規行為的,藥品監管部門及時開展現場檢查,并根據檢查結果采取相應的監管措施控制系統性風險,嚴厲打擊個別企業存在的違法違規行為。例如探索性研究發現部分批次麝香壯骨膏涉嫌存在人為投料錯誤或非法添加麝香草酚等問題,經檢查發現個別企業存在生產質量管理安全隱患,物料交叉感染,投料原料未全檢驗等問題。通過抽檢與檢查、稽查執法等工作有機銜接,形成高效協同的監管合力,個別企業逃避監管的違法違規的企圖得到有效遏制,質量安全意識逐步增強。
(四)風險提示—推動產業升級
對于探索性研究發現的安全風險較低、非主觀故意且未涉嫌違法違規的一般性風險信息,藥品監管部門對相關企業進行風險提示,督促指導相關企業對可能存在的質量風險因素進行深入排查、認真整改。例如,在探索性研究中發現部分批次小兒肺熱寧膠囊易氧化成分含量下降較明顯,提示聚酯/鋁/聚乙烯藥用復合膜包裝材料對氧氣的阻隔性能會影響此類制劑的質量;部分批次止咳桃花散的包裝材料對麝香酮的吸附率高達85%,不適用于止咳桃花散的包裝;部分批次奧利司他膠囊同一批次不同包裝間藥品質量存在差異及內容物顆粒粘黏膠囊殼的情況,存在生產工藝不合理或控制不到位等問題。企業就風險提示開展排查、分析和驗證,采取優化生產工藝、提高內控標準、加強原輔包質量控制等整改措施,提升產品質量水平。
(五)社會共治—助力科學監管
國家藥監局繼續以通告的形式,依法及時向公眾發布不符合規定產品信息,筑牢公眾用藥安全防線,全年共發布藥品質量通告5期。中檢院持續在官方網站公開國家藥品抽檢的探索性研究情況,2021年共發布102個品種的新建檢驗方法、承檢機構及聯系方式等內容,這種寓服務于監管的模式,有利于促進上市持有人的質量安全意識和主體責任自律意識,通過信息的共享利用,針對發現的藥品質量問題和檢驗檢測新技術進行交流,促進產品研發創新升級。
依托國家藥品抽檢結果,2021年9月,“藥品質量安全年會”以線上形式舉辦,搭建檢驗檢測生產研發機構信息交流平臺,分析檢驗檢測數據,挖掘質量安全問題,助推藥品產業發展提質升級,成為行業內獲取藥品質量提升信息的重要渠道之一。
四、結語
2021年國家藥品抽檢工作順利完成。檢驗及研究結果顯示,我國藥品質量仍處于較高水平,整體安全形勢平穩可控。
2022年是“十四五”規劃的起步之年,正值向著全面建成社會主義現代化強國的第二個百年奮斗目標邁進的重大歷史關頭。人民藥監初心如磐,國家藥監局將繼續堅持人民至上、保障用藥安全有效、助力保障疫情防控大局,不斷推進藥品抽檢制度體系現代化,健全完善藥品抽檢模式,大力發展監管科學和智慧監管,多措并舉提升技術支撐能力,堅決守住藥品安全質量底線,助力產業高質量發展。
小貼士
1.藥品抽檢歷史沿革
1956年,我國首次提出藥品計劃抽檢的概念;1964年,原衛生部第一次制定國家級年度藥品抽檢計劃并組織實施;1984年頒布《中華人民共和國藥品管理法》,第一次從法律上明確了藥品抽檢工作的地位;1986年,實行藥品質量公報制度;1990年,實行藥品抽檢收費制度,即抽檢藥品須由被抽檢單位付檢驗費;2001年,《中華人民共和國藥品管理法》修訂,取消了藥品抽檢收費制度,所需費用由財政列支;2019年,《中華人民共和國藥品管理法》再次修訂,明確“藥品監督管理部門根據監督管理的需要,可以對藥品質量進行抽查檢驗”“抽樣應當購買樣品”。
2.藥品標準檢驗
藥品標準檢驗是指具有檢驗資質的藥品檢驗機構,依據國家藥品監督管理部門批準的法定檢驗標準中的檢驗方法,進行全項目或部分項目的檢驗,并依法出具檢驗報告書的過程。
3.探索性研究
探索性研究是指在國家藥品抽檢過程中,除按照國家藥品標準進行檢驗并判定藥品是否符合標準規定之外,針對可能存在的質量問題,應用該品種國家藥品標準以外的檢驗項目和檢測方法對藥品質量進行進一步分析研究的過程。探索性研究結果不作為判定藥品合格與否的依據,可為進一步提升藥品質量水平、加強藥品監管提供技術支持。
4.國家基本藥物
國家基本藥物是適應基本醫療衛生需求,劑型適宜,價格合理,能夠保障供應,公眾可公平獲得的藥品。國家基本藥物目錄是各級醫療衛生機構配備使用藥品的依據。《國家基本藥物目錄(2018年版)》中的藥品包括化學藥品和生物制品、中成藥、中藥飲片3部分,其中,化學藥品和生物制品主要依據臨床藥理學分類,共 417個品種;中成藥主要依據功能分類,共268個品種;中藥飲片不列具體品種,頒布國家標準的中藥飲片為國家基本藥物,國家另有規定的除外。
5.藥品補充檢驗方法
藥品補充檢驗方法和檢驗項目(藥品補充檢驗方法)適用于有摻雜、摻假嫌疑,且國家藥品標準規定的檢驗方法和檢驗項目不能檢驗的藥品檢驗。經國務院藥品監督管理部門批準后,使用補充檢驗方法和檢驗項目所得出的檢驗結果,可以作為藥品監督管理部門認定藥品質量的依據。
6.檢驗項目
性狀項下記載藥品的外觀、臭、味、溶解度以及物理常數等,在一定程度上反映藥品的質量特性。
鑒別項下規定的試驗方法,系根據反映該藥品的某些物理、化學或生物學等特性所進行的藥物鑒別試驗,不完全代表對該藥品化學結構的確認。
檢查項下包括反映藥品的安全性與有效性的試驗方法和限度、均一性與純度等制備工藝要求等內容;對于規定中的各種雜質檢查項目,系指該藥品在按既定工藝進行生產和正常貯藏過程中可能含有或產生并需控制的雜質(如殘留溶劑、有關物質等);改變生產工藝時需另考慮增修訂有關項目。
含量測定項下規定的試驗方法,用于測定原料及制劑中有效成分的含量,一般可采用化學、儀器或生物測定方法。
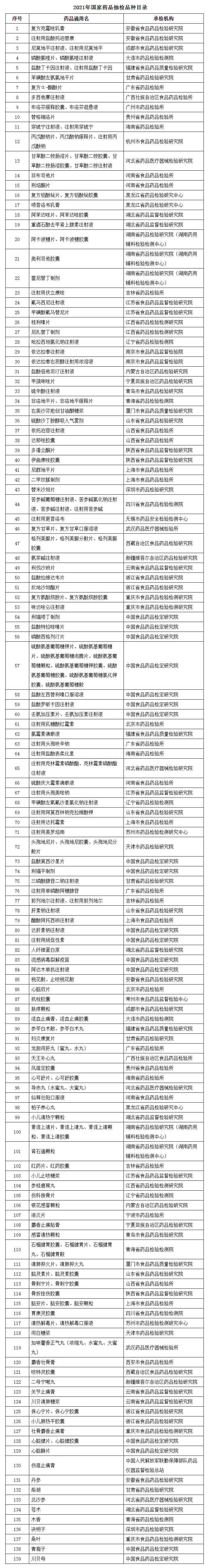
附表:2021年國家藥品抽檢品種目錄
附表
相關新聞

美歐日醫療器械監管法律制度概覽與思考
2000年,中華人民共和國國務院令第276號公布了《醫療器械監督管理條例》(以下簡稱《條例》),構建了醫療器械法律制度的框架,我國醫療器械走上了依法治理的軌道。此后《條例》歷經多次修訂和修改。2021年施行的新版《條例》貫徹“四個最嚴”要求,全面落實黨中央、國務院關于醫療器械審評審批制度改革精神,為鼓勵醫療器械產業創新高質量發展提供了堅實的法治保障。
9537個小時之前

最暢銷的基因與細胞療法TOP10盤點
2017年是細胞和基因治療領域具有里程碑意義的一年,在這一年里,美國食品和藥品監督管理局(FDA)批準了首款CAR-T細胞療法(Kymriah)上市,還批準了首款AAV基因療法(Luxturna)上市。
9879個小時之前

檢查員說 | 淺談藥物警戒檢查后企業整改常見問題及解決辦法
自2021年12月1日《藥物警戒質量管理規范》(以下簡稱GVP)實施后,截至2023年底,筆者所在的北京市藥品不良反應監測中心針對藥品上市許可持有人開展了107家次GVP符合性檢查。檢查員在督促企業整改過程中,常常發現企業不能一次性完成整改,一些問題不能及時糾正,大大降低了檢查整改工作效率。現對藥物警戒檢查后企業整改后出現的常見問題進行梳理并提出相關建議。
9879個小時之前

降脂“藥王”縮水76億,3款新藥大漲超100%!海正、魯南、京新獨家產品突圍
血脂調節劑是心腦血管系統藥物中重要的品類之一,也是首批被國采盯上的臨床常用藥物。經歷了國采五年時間,該類藥物的市場規模大幅縮水,2020年至今在中國公立醫療機構終端已無百億品種,新上市產品則持續爆發活力。2023年信達生物的托萊西單抗注射液獲批,成為近年來首個上市的血脂調節劑生物藥1類新藥,打破了進口藥獨占市場的局面,君實、康方、恒瑞的PCSK9抑制劑正在沖刺上市,國內血脂調節劑市場又將迎來新局面。
9992個小時之前













