“十三五”醫藥產業生態變化及亮點
發布日期:2022-03-04 閱讀次數:11539 來源:中國醫藥報
摘要:



“十三五”期間,國際國內經濟環境發生雙重變化,醫藥產業在高增長模式中轉軌,在一定程度上實現了產業生態的深度調整和產業結構的重構優化,發展模式逐步由高速度發展轉向高質量發展。
醫藥產業生態發生的重要變化突出體現在四個方面。
一、新藥研發創新進入“黃金期”
“十三五”期間,得益于新藥審評審批、醫保市場準入、建立融資渠道等創新要素改革聯動,醫藥市場初步建立了新藥創新投資回報的良性生態,極大激發了企業創新研發的動力。海外高端人才紛紛回國創業,CDMO(Contract Development and Manufacturing Organization,合同研發生產組織)發展迅猛,創新模式與國際接軌,臨床急需的新藥加速獲批上市,我國藥物創新開始在全球新藥研發舞臺上嶄露頭角。
(一)藥品審評審批制度改革破除創新阻滯
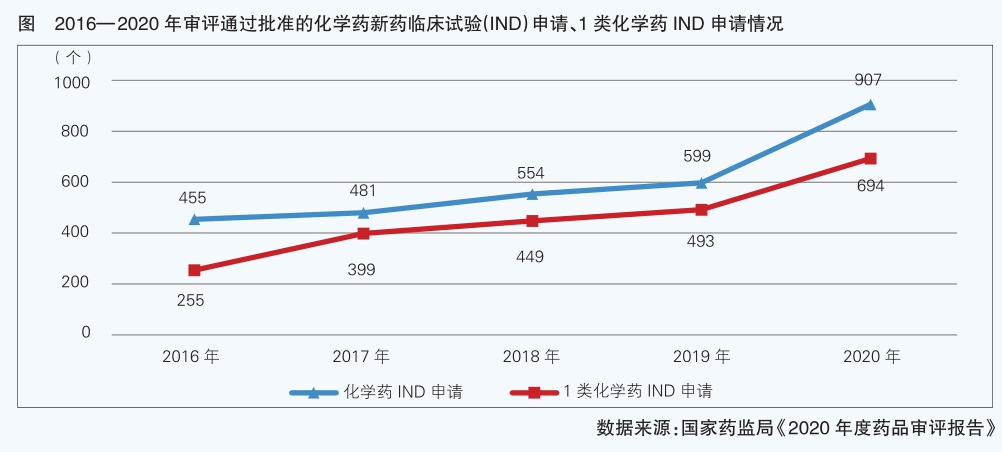
“十三五”期間,《中華人民共和國疫苗管理法》和新修訂《中華人民共和國藥品管理法》《醫療器械監督管理條例》頒布實施,隨著新修訂《藥品注冊管理辦法》以及《醫療器械注冊與備案管理辦法》等配套法規的出臺,藥品審評審批改革有序推進,特別是《關于發布化學藥品注冊分類改革工作方案的公告》對創新藥重新界定,指明了創新藥發展方向。臨床試驗管理、藥品專利鏈接制度、藥品上市許可持有人(MAH)制度等打通了新藥創制鏈條上的“卡頓”環節,同時通過建立新藥臨床試驗溝通交流機制、開辟審評審批快速通道,提高了審評效率,企業創新活力被釋放。2020年,國家藥監局藥品審評中心審結注冊申請任務按時限完成率94.48%,其中臨床急需境外已上市新藥注冊申請審結任務整體按時限完成率為100%,按默示許可受理注冊申請的審結任務整體按時限完成率為99.87%,臨床試驗申請平均審評用時由2015年的16個月壓縮至50天,直接行政審批的注冊申請100%在法定的20個工作日內完成,且審批平均用時縮短到11.8個工作日。
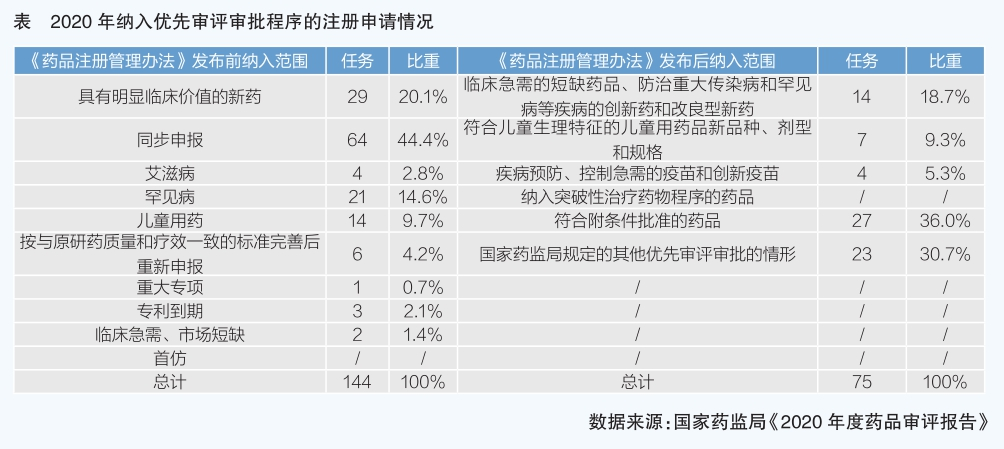
創新是推動醫藥產業高質量發展的重要動能。國家藥監局結合我國醫藥產業發展和臨床需求實際,參考國際經驗,設立了特別審批、突破性治療藥物、附條件批準、優先審評審批四個藥品加快上市程序,為創新藥上市開“綠燈”。加快上市程序的實施,大幅縮短了新藥研發上市周期,企業嘗到了創新的甜頭,創新藥成為許多企業戰略轉型的方向。
(二)國家醫保為創新藥上市開辟渠道
為擴大醫保資金保障范圍,提高保障水平,根據中共中央、國務院《關于深化醫藥衛生體制改革的意見》提出的“積極探索建立醫療保險經辦機構與醫療機構、藥品供應商的談判機制”要求,藥品價格首次談判于2016年啟動,替諾福韋酯、埃克替尼、吉非替尼3個品種以平均降價59%的幅度進入國家醫保目錄,目錄調整周期也從7年縮短至1年,目錄藥品動態調整機制初步建立。
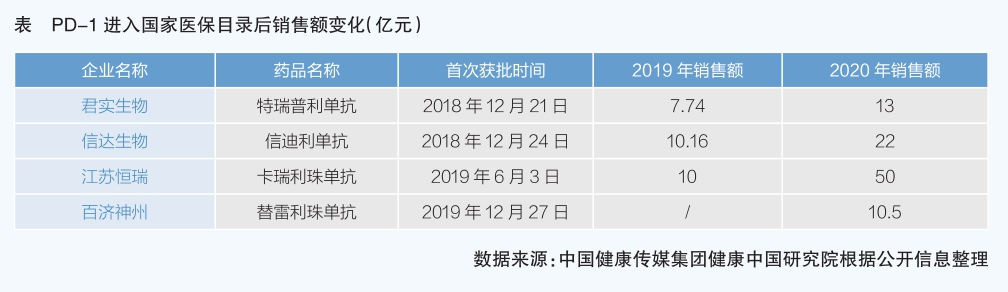
據《中國醫保藥品管理改革進展與成效》藍皮書,2018—2020年,國家醫保目錄共計新增433個新藥好藥,涉及癌癥、罕見病、肝炎、糖尿病、風濕免疫等多個臨床治療領域;183個藥品被調出目錄。2020年,全國通過省級藥品集中采購平臺網采訂單總金額為9312億元,其中醫保目錄內藥品在網采訂單總金額中占比86.5%,金額為8052億元。2018—2020年,與談判前市場價格相比,累計為患者減負近1700億元。臨床急需的新藥,從獲批上市到進入國家醫保目錄、實現在醫療機構銷售的時間縮短至兩年以內,企業銷售開發費用大幅減少,銷售量成倍增長。
2018年,新組建的國家醫療保障局在全國11個市開展國家藥品集中采購試點工作,宣告醫療機構藥品招標進入“以價換量”新階段。截至2020年底,國家藥品集采已經進行了四批五輪,覆蓋218個品種。中國醫療保險研究會選取了9種藥品,對全國情況的不完全統計顯示,集采結果實施后一年,中選仿制藥采購量大幅上升,年總采購量增加了265.2%;未中選原研藥全國年總采購量較上一年平均下降46%,降幅最大的達74.4%;未中選仿制藥年總采購量降幅達80.8%,且各藥品采購量降幅都在70%以上。同通用名下,原研藥、中選仿制藥和未中選仿制藥平均價格均明顯降低,中選仿制藥市場份額擴大,顯著減輕群眾用藥負擔。2020年全國通過省級藥品集中采購平臺網采訂單總金額為9312億元,比2019年下降601億元。
新藥市場準入的聯動改革,推動更多企業投身創新掘金浪潮,新藥研發篩選視野不僅放在即將過期的專利藥“搶仿”上,也開始放在全球創新藥熱門靶點產品線布局上。我國有豐富的臨床資源、廣闊的醫藥市場以及快速發展的CDMO,逐漸成為全球創新藥舞臺上一支新生力量。我國新藥注冊申請、通過審批數量與美國快速接近。
(三)建立擴大新藥研發融資渠道
新藥研發周期長、投入大,風險高,一款新藥從藥物發現到臨床研究再到獲批上市,一般需10年,研發成本10億美元起步,而從進入Ⅰ期臨床試驗至最終獲批上市的總成功率不到10%。為化解研發風險,近年來研發分工越來越精細,研發外包興起。有別于仿制藥企業,創新藥主體中存在大量小微企業,它們在創新初期往往沒有現金收入支撐長期且昂貴的研發支出,多通過股權方式募集資金,因此,融資是新藥研發創新中重要的支撐。
2018年11月,上交所設立科創板(于2019年6月13日正式開板)。科創板設立的目的是重點支持新一代信息技術、高端裝備、新材料、新能源、節能環保以及生物醫藥等高新技術產業和戰略性新興產業,推動互聯網、大數據、云計算、人工智能和制造業深度融合。2018年4月,香港聯交所修訂主板上市規則,新增第18A章《生物科技公司》,允許未有收入、未有利潤的生物科技公司提交上市申請。上述定向開辟的融資渠道為新藥創新注入一針興奮劑,創新價值得到資本市場熱烈回應,小微創新型獨角獸企業紛紛崛起,我國成為全球創新投資的熱土。
硅谷銀行發布的《2020年投融資報告》指出,2020年中國醫療健康風險投資交易總計達到創紀錄的121億美元,與2019年相比翻了1倍,也創下了投融資金額的新紀錄。其中,生物醫藥、醫療器械、診斷/工具領域都實現了100%以上的增長。風險投資支持的初創公司大多數依靠投資者的支持,其中最為活躍的投資者包括高瓴資本、啟明創投、紅杉資本、禮來亞洲基金等。在生物醫藥領域,腫瘤學和平臺技術名列前茅,分別吸引到28億美元和21億美元風險投資。受新冠肺炎疫情影響,2020年抗感染領域吸引的風投資金比2019年增長了10倍。
生物醫藥是新藥創新的高地,高投入、高風險、高技術含量、高壁壘及高收益的特點使其頗受投資者青睞,尤其2018年香港18A新政及科創板啟動重大利好下,資本市場熱情高漲。盡管當年受資本市場消沉情緒等負面影響,VC/PE募資困難,大批初創企業面臨生存問題,但醫療健康行業仍位列融資“吸金”前列。
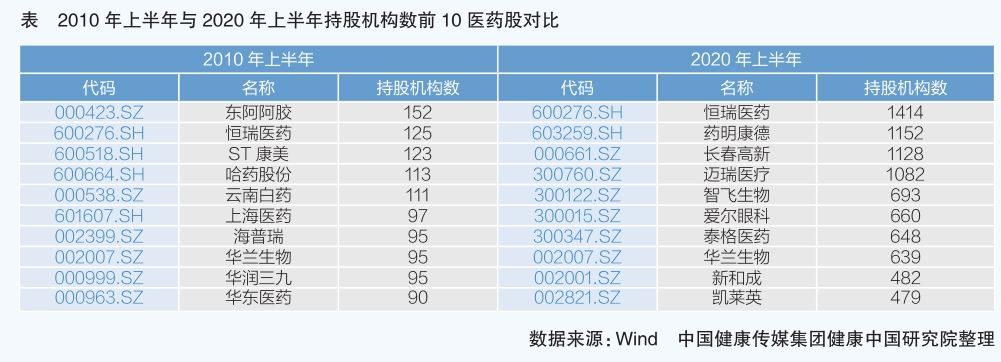
金融機構對醫藥上市公司投資持倉情況能夠反映資本市場的傾向。2020年以前,機構青睞擁有獨家產品、價值獨特的企業;2020年以后,機構逐漸轉向創新能力強、有核心競爭力產品的公司,“小而美”的公司甚至估值更高。同時,機構在醫藥板塊的持倉數量大幅增長,醫藥板塊受到資本熱烈追捧,醫藥板塊由于創新驅動迎來春天。
二、仿制藥一致性評價夯實醫藥產業高質量發展基礎
我國醫藥產業起步較晚,生產制造基礎和研究基礎較為薄弱,2007年以前獲批上市的藥品90%以上為仿制藥且以仿標準為主,藥學研究及與原研藥質量和療效一致性評價研究不足。盡管仿制藥價格低廉,但在與原研藥的競爭中處于劣勢。很長一段時間,原研藥即使過了專利保護期,在我國的銷售價格仍然較高,在醫院用藥中的占比也較高,占用了大量醫保資金。而在發達國家和地區,推動仿制藥替代原研藥是減輕醫療負擔、提升患者用藥可負擔性和可及性的重要舉措。2017年,美國食品藥品管理局(FDA)宣布了“藥物競爭行動計劃”,以鼓勵仿制藥進行市場競爭,降低藥價。據FDA公開信息,2009年至2019年仿制藥為美國醫療保健系統節省了近2.2萬億美元。
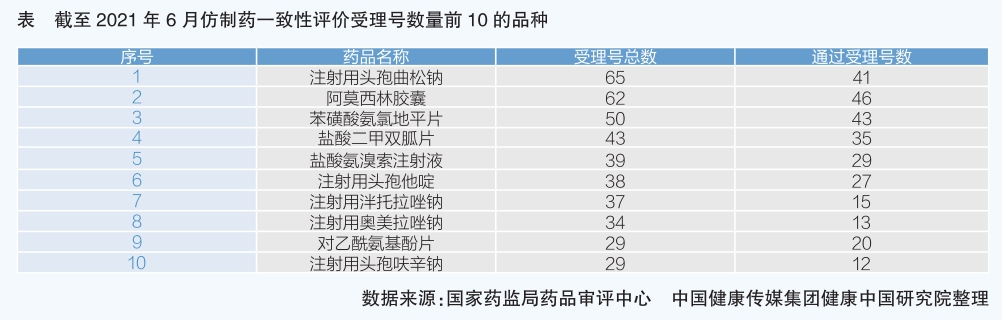
2016年,國務院辦公廳發布《關于開展仿制藥質量和療效一致性評價的意見》,要求“化學藥品新注冊分類實施前批準上市的仿制藥,凡未按照與原研藥品質量和療效一致原則審批的,均須開展一致性評價”,涉及的289個品種要在2018年底通過評價,質量和療效達到與原研藥一致,實現臨床可替代。與此呼應,2018年國家醫療保障局在全國11個市開展國家藥品集中采購試點工作。按照要求,參與集采的藥品必須通過仿制藥質量和療效一致性評價。在國家藥監部門大力推動下,仿制藥一致性評價工作有序展開,企業參與熱情逐年提升,2017年以來,仿制藥一致性評價過評品種數量逐年攀升。截至2020年底,累計通過和視同通過仿制藥一致性評價的品種445個,約占常用化學藥品的三分之一,包括口服固體制劑321個、注射劑86個、其他劑型38個。在通過仿制藥一致性評價的受理號中,抗感染、高血壓、糖尿病用藥占比較高。
仿制藥一致性評價被譽為我國仿制藥的“歷史性補課”,不僅是藥品審評審批制度改革的重要內容之一,也是供給側結構性改革在醫藥產業的具體落實。仿制藥一致性評價以提高仿制藥質量為最終目的,以實現臨床上與原研藥相互替代為標準,提升國產仿制藥競爭力,同時起到淘汰落后產能、降低醫藥總費用支出的作用。與我國情況類似,日本于1998年啟動“藥品品質再評價工程”,旨在保障仿制藥在安全性和有效性上與原研藥一致,消除醫生和患者顧慮。該項工程耗時14年,完成了1000余個品種,壓縮了日本中小規模藥企生存空間,企業數量銳減,仿制藥市場份額向頭部企業集中。在這種情況下,企業想要生存必須尋求新的利潤增長點,于是紛紛轉向新藥創新研發。從我國開展仿制藥一致性評價的情況看,提高產業集中度、淘汰落后產能、生產經營提質增效的特點同樣突出,大型規模以上企業是開展仿制藥一致性評價的主體,通過仿制藥一致性評價的企業生產經營效率、效益得到提升,運營情況良好;未參與的企業市場空間被壓縮,發展后勁不足。
三、我國醫藥產業國際化進程加快
“十三五”期間,我國醫藥產業國際化進程繼續加快,主要表現在四個方面。
一是在高端市場注冊數量大幅增長,制藥水平、研發能力越來越受到高端市場認可。“十三五”期間,我國制劑在美ANDA(仿制藥申請)獲批數量大幅增長,2018年共獲得71個ANDA批準,其中16個為暫時性批準。2019年,我國藥企有86個仿制藥獲得ANDA批準,包括13個暫時性批準,占比15%。2020年,我國藥企獲美國FDA批準的仿制藥和暫時性批準數量分別是80個和16個,獲批ANDA最多的企業是復星醫藥。
特別值得提及的是,2019年11月15日,百濟神州公司宣布,其自主研發的BTK抑制劑澤布替尼通過美國FDA加速批準,用于治療既往接受過至少一項療法的套細胞淋巴瘤(MCL)患者。這標志著澤布替尼成為首款完全由我國企業自主研發、在美國獲準上市的抗癌新藥,實現中國原研新藥出海“零突破”。同年,石藥歐意藥業本土創新的馬來酸左旋氨氯地平也獲得美國FDA新藥上市批準。
二是醫藥企業通過授權引進/合作(License-in/out)深度參與全球新藥研發。近年來,隨著藥物研發全球化進程的加速,越來越多的跨國藥企和我國藥企通過開展國際多中心臨床試驗,支持全球注冊申請。藥品境內外同步研發可減少不必要的重復研究,加快藥品上市。2018年7月,國家藥監局發布《接受藥品境外臨床試驗數據的技術指導原則》,鼓勵開展境內外同步研發,境外臨床試驗數據可以用于支持需要進行有效性和/或安全性評價的各類注冊申請。創新藥企抓住政策機遇,頻頻通過License-in /out方式豐富產品線,與海外生物技術企業或制藥企業在研發、生產、商業化等方面開展合作,探索更加開放、創新的研發模式。在2020年登記的新藥臨床試驗中,國際多中心試驗占比為14.1%(208項,含不在中國招募受試者的國際多中心試驗1項)。
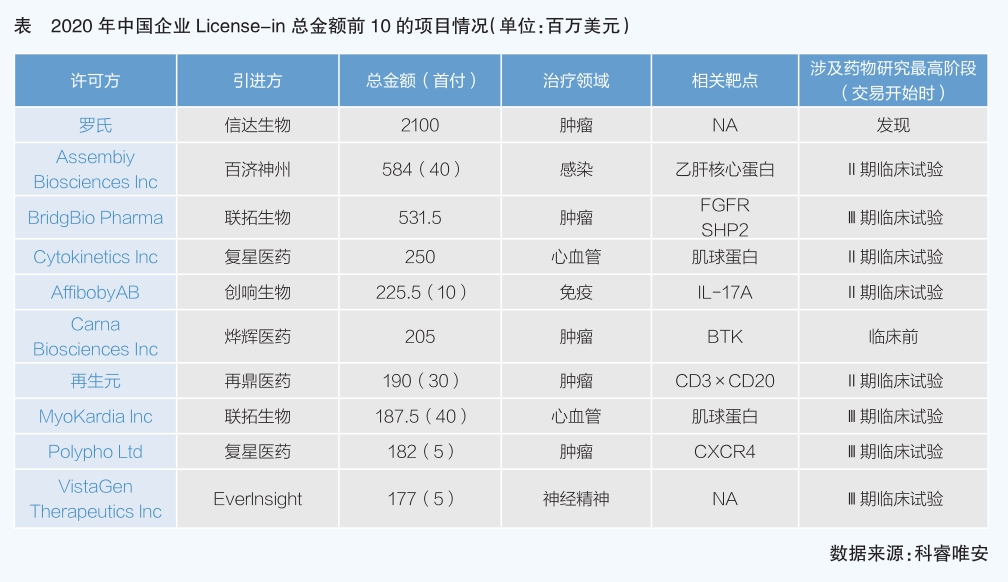
2020年我國醫藥企業開展的License-in項目合同金額較大,Top10項目中最少金額1.77億美元。項目涉及多病種領域,以腫瘤最多,其次為心血管,且兩個心血管項目均為肌球蛋白。項目起點以Ⅱ期臨床試驗為主,Biotech購買力強勁。
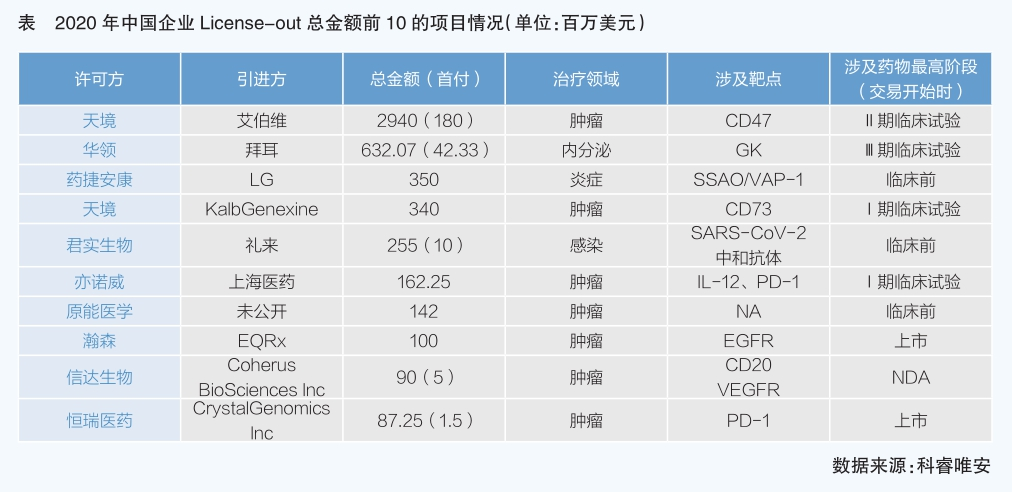
2020年,在中國企業開展的License-out項目中,領先交易的對外許可水平已達國際水平,交易領域主要集中在腫瘤,項目起點分布在臨床研究各階段。在開展的項目合作中,模式創新看點很多,合作雙方不拘泥于屬于資產層面的臨床開發,24%的項目賣去美國。
三是境外并購仍是我國藥企國際化的路徑之一。“十三五”期間,醫藥健康領域的海外并購涉及血液制品、仿制藥、醫療器械、CRO(合同研究組織)、生物醫藥、營養保健等多個領域,主要需求是開拓海外營銷渠道、延伸產品線,目的是開展境外臨床試驗,提高市場占有率,完善產業鏈布局,掌握核心技術。從被并購標的所屬國家和地區來看,美國為中國企業境外并購第一目的地,歐洲緊隨其后,在東南亞則聚焦醫療服務市場,在大洋洲主要并購具備優勢的營養健康企業。
四是我國藥企積極參與國際組織全球采購。特別是新冠肺炎疫情發生后,我國醫藥商品進入國際組織采購名單的數量激增,其中,醫療設備在國際采購中表現搶眼,展現了中國制造的實力。
四、新藥創制為高質量發展注入新動能
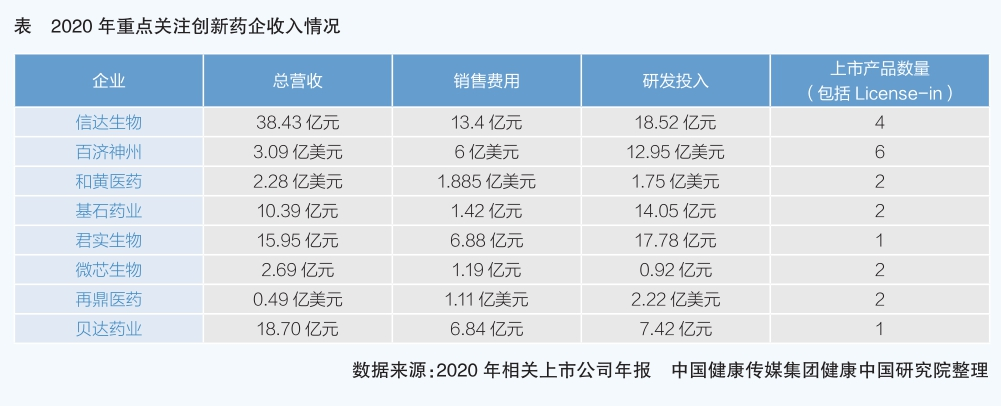
長期以來,我國醫藥市場一直以仿制藥銷售為主,創新藥銷售主要由外資企業把持。“十三五”期間,國產創新藥為產業發展注入新動能,創新藥銷售收入的行業貢獻持續提升,研發投入持續提升;新興創新藥企異軍突起,為市場注入“新鮮血液”,老牌大型藥企離開舒適圈,煥發勃勃生機,行業轉型迭代加速。作為老牌大型醫藥企業的代表,恒瑞醫藥2015年后加大創新研發投入,注冊申請上市的創新藥成為企業經營新的增長點,新藥貢獻從2015年的1億元占企業經營收入的1%,上升到2020年的17億元占企業經營收入的17%。同時,新興創新企業新藥營收也在近兩年大幅增長。
高新技術企業是創新研發的重要載體,它們的發展情況直接反映創新與技術帶給產業發展的變化。國家統計局公布的全國高新技術企業發展關鍵數據中,醫藥高新技術企業表現突出。2016—2019年,醫藥高新技術企業不僅新產品開發經費支出持續增長,新產品銷售收入也大幅上升。
相關新聞

美歐日醫療器械監管法律制度概覽與思考
2000年,中華人民共和國國務院令第276號公布了《醫療器械監督管理條例》(以下簡稱《條例》),構建了醫療器械法律制度的框架,我國醫療器械走上了依法治理的軌道。此后《條例》歷經多次修訂和修改。2021年施行的新版《條例》貫徹“四個最嚴”要求,全面落實黨中央、國務院關于醫療器械審評審批制度改革精神,為鼓勵醫療器械產業創新高質量發展提供了堅實的法治保障。
9538個小時之前

最暢銷的基因與細胞療法TOP10盤點
2017年是細胞和基因治療領域具有里程碑意義的一年,在這一年里,美國食品和藥品監督管理局(FDA)批準了首款CAR-T細胞療法(Kymriah)上市,還批準了首款AAV基因療法(Luxturna)上市。
9880個小時之前

檢查員說 | 淺談藥物警戒檢查后企業整改常見問題及解決辦法
自2021年12月1日《藥物警戒質量管理規范》(以下簡稱GVP)實施后,截至2023年底,筆者所在的北京市藥品不良反應監測中心針對藥品上市許可持有人開展了107家次GVP符合性檢查。檢查員在督促企業整改過程中,常常發現企業不能一次性完成整改,一些問題不能及時糾正,大大降低了檢查整改工作效率。現對藥物警戒檢查后企業整改后出現的常見問題進行梳理并提出相關建議。
9880個小時之前

降脂“藥王”縮水76億,3款新藥大漲超100%!海正、魯南、京新獨家產品突圍
血脂調節劑是心腦血管系統藥物中重要的品類之一,也是首批被國采盯上的臨床常用藥物。經歷了國采五年時間,該類藥物的市場規模大幅縮水,2020年至今在中國公立醫療機構終端已無百億品種,新上市產品則持續爆發活力。2023年信達生物的托萊西單抗注射液獲批,成為近年來首個上市的血脂調節劑生物藥1類新藥,打破了進口藥獨占市場的局面,君實、康方、恒瑞的PCSK9抑制劑正在沖刺上市,國內血脂調節劑市場又將迎來新局面。
9993個小時之前













