醫(yī)藥行業(yè)2022年度策略
發(fā)布日期:2022-01-27 閱讀次數(shù):12683 來源:動銷發(fā)布
摘要:
1、行業(yè)步入高質量發(fā)展進化期,全面擁抱新成長機遇
1.1 2021 年回顧—震蕩中夯實行業(yè)基礎,進化中涌現(xiàn)眾多新機遇
2021 年是醫(yī)藥指數(shù)大幅震蕩的一年,也是行業(yè)全新一輪進化的醞釀期。復盤過去十年的醫(yī)藥行情,大致可以分為兩個大的時代:
1) 醫(yī)保擴容增量期,本土特色崛起時代:2009 年國家醫(yī)保目錄制定后,中國醫(yī)藥行業(yè)迎來醫(yī)保目錄擴容期,擴容期帶來的是進入門檻的降低,使得 2015 年及 2015 年之前的醫(yī)藥行業(yè) 極具本土特色,以仿制藥、中藥、中藥注射劑擴容為重;
2) 醫(yī)保控費騰籠換鳥,全面鼓勵創(chuàng)新時代:2015 年中國實現(xiàn)三保合一,首次實現(xiàn)全民醫(yī)保覆 蓋,中國的醫(yī)保從擴容期轉向控費期,藥政方面從畢井泉局長就任國家食藥監(jiān)總局局長后開啟了一輪完整的從研發(fā)段到資本端再到支付端的全流程藥政改革,基本重塑了行業(yè)的產(chǎn)業(yè)邏輯,同海外接軌,中國醫(yī)藥市場進入到騰籠換鳥、全面鼓勵創(chuàng)新的時期。
基于國內完整的制造產(chǎn)業(yè)鏈、龐大的內需市場和海外出口的巨大空間,新的醫(yī)藥規(guī)則讓投資者看到了各個方面 的廣大前景,因此無論是一級還是二級市場,醫(yī)藥行業(yè)的明星賽道均涌入了海量資金,賽道 估值和熱度被推到了前所未有的高度。
但不可忽視的是,首先自上而下的政策改革除了對新方向的大力鼓勵,也需要對新興方向的發(fā)展 進行規(guī)范矯正,同時還蘊含對老方向和舊產(chǎn)能的出清,但由于行業(yè)發(fā)展和資金投入的慣性,舊產(chǎn) 業(yè)結構的改革和新方向的規(guī)范調整需要更長時間去消化,因此在行業(yè)蓬勃向上發(fā)展的康莊大道上, 總會遇到多次的“矯正”和“回撤”,可以理解為夯實基礎后有待更好的高質量發(fā)展。
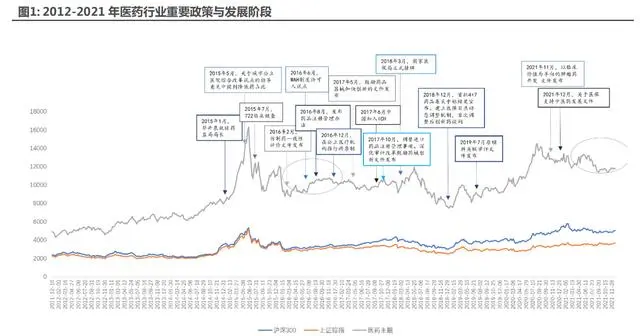
2021 年可類比歷史上的“2016 年”,“震蕩”和“進化”是 2021 年的兩個底色。我們認為 2021 年既是夯實基礎的一年,前期主要的明星賽道如”創(chuàng)新藥”、”醫(yī)療服務”、”CXO”在年內均經(jīng)歷 了多次反復的震蕩,估值和指數(shù)往往是伴隨著行業(yè)的基本面變化或者預期可能發(fā)生的變化而產(chǎn)生, 消化估值只是最淺顯的表述,核心在于產(chǎn)業(yè)開始進入了調整期,在震蕩期中夯實基礎、在震蕩中 完成進化。
同時 2021 年又是醫(yī)藥進化的一年,2021 年末我們看到了眾多醫(yī)藥新賽道的誕生, 且多數(shù)與中國醫(yī)藥產(chǎn)業(yè)鏈的自主自強和醫(yī)藥新科技有關,如”生命科學產(chǎn)業(yè)鏈”、”制藥裝備”賽 道、細胞與基因治療等。類比歷史上的進化期,上一次產(chǎn)業(yè)邏輯、產(chǎn)業(yè)政策新舊交替的進化期是 2016 年,醫(yī)保擴容+藥政改革開始的第一年,全年的行情演繹與 2021 年尤為相似,而往后看 一年的 2017 年也是進化后新賽道諸如”CXO”、”醫(yī)療服務”、化學發(fā)光等不斷出現(xiàn)的一年,溫 故而知,產(chǎn)業(yè)進化期最值得期待的就是新賽道、新龍頭的不斷涌現(xiàn)崛起。
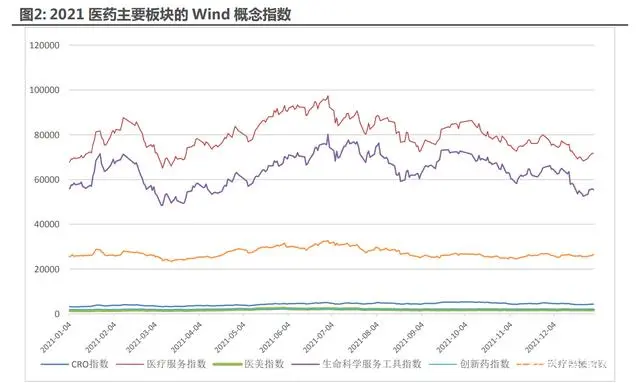
1.2 展望 2022 年—重點關注新方向潛力,傳統(tǒng)方向性價比逐步凸顯
首先要重新定義和豐富醫(yī)藥行業(yè)投資框架。近年來,在上述因素的推動下,行業(yè)除了傳統(tǒng)的 藥械等領域的創(chuàng)新性不斷增強以外,也涌現(xiàn)出眾多新的商業(yè)模式與創(chuàng)新業(yè)態(tài),如 AI 醫(yī)療、癌癥 早篩、3D 打印、生命科學、健康服務等。基于醫(yī)藥行業(yè)發(fā)生的眾多積極變化及衍生出來的細分 賽道,傳統(tǒng)的分類方式已經(jīng)不能夠滿足醫(yī)藥行業(yè)的新需求,因此我們在過往團隊研究積累的基礎 上,基于行業(yè)本質將醫(yī)藥行業(yè)重新進行更具包容性的劃分,主要分為醫(yī)藥真創(chuàng)新、醫(yī)藥新制造和 醫(yī)藥新消費三大主線共十二條細分賽道,基本囊括目前未來十年的醫(yī)藥行業(yè)新生態(tài)。
首先,許多傳統(tǒng)的賽道經(jīng)過一年多的估值消化和產(chǎn)業(yè)更新迭代,已經(jīng)到了合適性價比的配置區(qū)間, 如產(chǎn)業(yè)邏輯一直不變的”CXO”賽道、處于估值底部積極變化趨勢明顯的中藥賽道、產(chǎn)業(yè)升級明 確今年卻調整充分的”創(chuàng)新藥”賽道等等;其次在創(chuàng)新驅動和整個國內制造業(yè)自主自強的大背景 下,將會有更多產(chǎn)業(yè)鏈上新方向的價值需要去繼續(xù)挖掘和發(fā)現(xiàn),比如”生命科學產(chǎn)業(yè)鏈”、手術 機器人、器械上游、AI 醫(yī)療、細胞基因治療、合成生物學等眾多新產(chǎn)業(yè)鏈的崛起。
2、“創(chuàng)新藥”:管線架構日益成熟,國際化大幕徐徐開啟
2.1 政策支持鑄就高質量發(fā)展頂層戰(zhàn)略,產(chǎn)業(yè)升級尋找真創(chuàng)新
中國創(chuàng)新藥產(chǎn)業(yè)的發(fā)展過程中,2015 年以前國內創(chuàng)新藥定義為國內未上市新藥,因此仿制 海外已上市且專利即將到期藥物在國內可以以新藥審批,該政策為國內輸送了大量國外經(jīng)典藥物, 滿足了臨床用藥基本需求。但由于當時仿制藥臨床數(shù)據(jù)監(jiān)察過程存在不規(guī)范、不完整的情況,大 量仿制藥與創(chuàng)新藥同時申報,擠占藥物審批資源,嚴重影響了藥品審評審批的正常進行。
2015 年 CFDA 發(fā)布 CFDA(現(xiàn) NMPA)《化學藥品注冊分類改革工作方案》,將新藥定義由 “中國新”改編為“全球新”,只有國內國外均未上市的新藥才能定義成創(chuàng)新藥,將新藥標準正 式與全球同步。同時 2015 年 7 月 22 號,CFDA 下發(fā)了《開展藥物臨床試驗數(shù)據(jù)自查核查的公 告》,要求注冊申請人主動開展臨床試驗數(shù)據(jù)的自查,上交,并在 117 號公告要求 1622 個臨床 試驗項目自查,最終結果為所有項目共撤回和不予批準總數(shù)為1277個,占應當核查的比重89.4%, 解放了評審資源,中國創(chuàng)新藥正式進入與國際接軌的新紀元。
2017 年 10 月 8 號,中共中央辦公廳和國務院辦公廳聯(lián)合印發(fā)《關于深化審評審批制度改 革鼓勵藥品醫(yī)療器械創(chuàng)新的意見》,制定了臨床試驗機構資格認定實行備案管理、推動上市許可 持有人制度(MAH)全面實施等重要措施。其中臨床試驗機構資格備案制簡化了臨床試驗機構 申請備案的流程,釋放了臨床試驗資源。MAH 制度將藥品上市許可與生產(chǎn)許可相分離,藥品上 市許可持有人可以委托第三方生產(chǎn)藥品,一方面解決了初創(chuàng)企業(yè)生產(chǎn)藥物進行臨床申報的問題, 另一方面憑借國內的優(yōu)秀及豐富工程師資源打造了一大批國際頂尖的”CXO”企業(yè)。該政策降低 了創(chuàng)新藥企業(yè)成立的門檻,極大提高了國內藥企的整體技術水平。
2021 年 7 月 2 號,CDE 發(fā)布《以臨床價值為導向的抗腫瘤藥物臨床研發(fā)指導原則》征求意 見稿,強調以患者需求為核心的研發(fā)理念。其政策背景主要針對目前新藥研發(fā)存在的新藥臨床試 驗同質化明顯,臨床患者資源浪費的情況,內容中重點要求對照組選擇最佳治療方案同時嚴格限 定了單臂試驗的試用范圍,體現(xiàn)了國家政策面對創(chuàng)新藥企業(yè)的進一步要求。
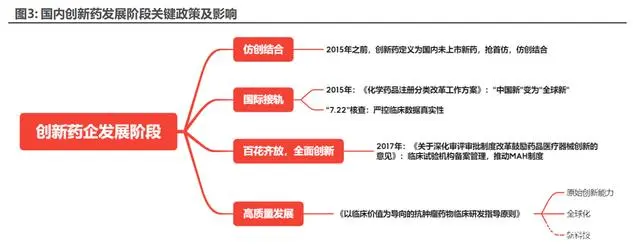
我們認為,國家相關政策整體在于引導國內創(chuàng)新藥企憑借國內豐富的臨床資源及優(yōu)秀的科研 團隊,逐步發(fā)展成為國際領先創(chuàng)新藥企。2015 年第一次政策調整后將寶貴的臨床及審批資源從 仿制藥轉向創(chuàng)新藥審批,2017 年進一步降低創(chuàng)新藥開發(fā)門檻,在此過程中信達生物,百濟神州、榮昌生物在內的一批創(chuàng)新藥企脫穎而出,以遠低于海外新藥的價格為中國患者提供了包括 PD-1 單抗,HER2-ADC 等一批國際一線新藥,滿足了中國患者需求。
2021 年,以臨床價值為導向的政策調整將會極大改善目前新藥研發(fā)申報過程中,在少數(shù)靶 點及藥物種類上重復性資源投入,保護患者權益防止患者資源浪費,未來很難會重現(xiàn) PD-1 研發(fā) 過程中幾十個新藥同時申報的情況。我們認為,未來幾年中,投資資金、臨床資源將會進一步向 具備原始創(chuàng)新能力、能夠打造新技術新科技同時具有全球化發(fā)展能力的真創(chuàng)新藥企傾斜,創(chuàng)新藥 產(chǎn)業(yè)有望整體升級。
2.2 支付手段多樣化,保基本促繁榮
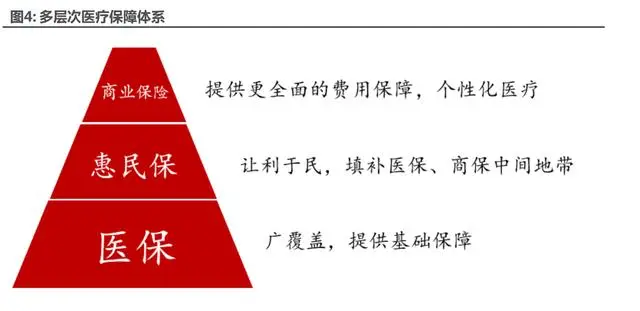
隨著經(jīng)濟發(fā)展及人民對健康生活水平要求的不斷提高,國家構建了多層醫(yī)療保障體系滿足不 同的醫(yī)療需求。其中醫(yī)保及商業(yè)保險經(jīng)過多年發(fā)展已日趨成熟,醫(yī)保主要保障居民基本醫(yī)療需求, 將報銷范圍限制在《國家醫(yī)保藥品目錄》內,重點在于保基本,廣覆蓋。
商業(yè)保險依靠個人自主選擇購買,相對收費較高,包含《國家醫(yī)保藥品目錄》外的創(chuàng)新藥、 進口藥等。目前主要包括商業(yè)百萬醫(yī)療險及更為昂貴商業(yè)中高端醫(yī)療險,由于投保門檻高,保費 貴等因素目前在醫(yī)療賠付中占比不高,2019 年占比僅為 5.6%。
為了更好滿足醫(yī)療保障需求,為大病患者減輕財政壓力,近年由政府主導,與基礎醫(yī)保深度 綁定的地區(qū)普惠型補充醫(yī)療保險——“惠民保”逐漸開始填補醫(yī)保與商保之間的空缺。相比于 醫(yī)保,其同時覆蓋醫(yī)保目錄內和部分醫(yī)保目錄外藥品。相比商業(yè)保險,其投保門檻顯著降低:(1) 較商業(yè)保險投保年齡限制寬松,年齡超過 60 歲仍可投保;(2)投保人無需進行健康告知,具有 三高等基礎病人群仍可投保 ;(3)職業(yè)不設限制,從事高風險職業(yè)例如礦工、機床工等同樣可 以購買。
醫(yī)保:醫(yī)保目錄國家級準入談判始于 2017 年版醫(yī)保目錄制定開始,通過對藥品臨床需求、 療效價值、重大創(chuàng)新進行反復專家論證,并以全國聯(lián)網(wǎng)隨機票決方式遴選,經(jīng)與企業(yè)協(xié)商最終確 定談判品種,此后歷年均進行了不同品種的醫(yī)保談判。
每年醫(yī)保目錄制定均重點考慮對創(chuàng)新藥的支持,2018 年醫(yī)保局更是專門組織了 18 種創(chuàng)新腫瘤藥的專項談判。在 2021 年醫(yī)保談判中,67 種談判成功的目錄外獨家藥品中, 有 66 種為去年上市藥物,新藥納入率 99%,體現(xiàn)了醫(yī)保對于創(chuàng)新支持的力度持續(xù)加大, 加速創(chuàng)新藥的商業(yè)化放量。
醫(yī)保整體定位仍在于“保基本”,新增的 74 種藥品預計 2022 年增加的基金支出與目錄 內藥品降價騰出的基金空間基本相當,品類擴大已不明顯增加基金支出為標準。諾西那 生鈉注射液降價至 33000 元/支,達雷妥尤單抗注射液 400mg/20ml 規(guī)格從 19710 元 降為 8512.4 元,降價 56.81%進入醫(yī)保,均體現(xiàn)醫(yī)保確保“普惠性”的政策出發(fā)點。
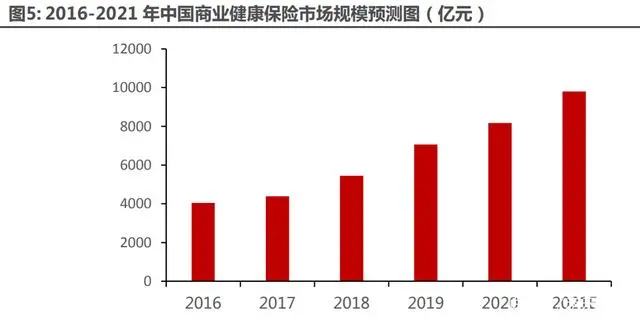
商業(yè)健康保險:中國商業(yè)健康保險市場規(guī)模從 2016 年 4042 億元增加至 2020 年 8193 億 元,CAGR 為 19.2%。目前正探索在醫(yī)保甲乙目錄的基礎上制定商報“丙類目錄”,將創(chuàng)新藥物、 醫(yī)療新技術、新器械納入商業(yè)健康保障范圍,滿足不同人群的個性化醫(yī)療需求。
惠民保:2015 年深圳率先推出“深圳市重大疾病補充醫(yī)療保險”,2019 年南京,珠海等城 市跟進,2020 年呈現(xiàn)“井噴”式發(fā)展,截至 2020 年底,全國共有 23 省 82 地區(qū)上線 111 款惠 民保產(chǎn)品,參保人數(shù)超 4000 萬。進入 2021 年,惠民保更是多點開花,至 10 月中旬,共有 58 家保險機構在 27 省份參與超過 100 個城市的定制型醫(yī)療保險項目,總參與人數(shù)超過 7000 萬, 較 2020 年 4000 萬進一步擴大。
作為旨在解決大病患者財務壓力的保險產(chǎn)品,惠民保定位于醫(yī)保的有效補充,早期納入的藥 物種類較少且大多與腫瘤治療相關,目前升級后的惠民保涵蓋特藥藥品數(shù)量大多在 15 至 25 種。其中,“北京普惠健康保”與“樂城特藥險”聯(lián)手保障的藥品種類達到 100 種,包括 75 種海外 特藥和 25 種國內特藥,更是首次納入了 siRNA 降脂藥 Inclisiran,距離其獲得歐盟批準用于高 膽固醇血癥僅過了 7 個月。
伴隨整體醫(yī)療支付體系的不斷完善,以醫(yī)保為基礎,惠民保作為醫(yī)保有效補充,商保滿足個性化醫(yī)療訂制需求的三重保障體系能夠有效維護醫(yī)療支付體系的平穩(wěn)健康發(fā)展。
2.3 “創(chuàng)新藥”出海:水到渠成,揚帆啟航
自從中國加入 ICH,國內藥物監(jiān)管政策標準逐步與國際接軌,實現(xiàn)國內與海外的標準互認, 奠定了創(chuàng)新藥出海基礎。目前出海主要由兩種形式:將海外權益授出的 License-out 模式和海外 臨床模式。
2.3.1 License-out :創(chuàng)新藥企研發(fā)水平日益增長,海外授權數(shù)量激增
License-out 模式適合國內大部分創(chuàng)新藥企,可實現(xiàn)在研項目快速出海,提升資金回流效率, 能夠以較少的時間和資金成本換來穩(wěn)定的首付款及相對較為豐厚的里程碑費用。2006 年 11 月微芯生物的西達苯胺成為國內首個 License-out 授權至海外的項目,開創(chuàng)中 國創(chuàng)新藥海外 License-out 的先河。然而隨后 5 年只有 1 起創(chuàng)新藥海外 License-out 案例,主 要原因在于當時國內醫(yī)藥研發(fā)氛圍仍以仿制藥為主,整體研發(fā)水平不足。2020 年堪稱中國創(chuàng)新 藥 License-out 元年,共有 42 起項目成功出海。
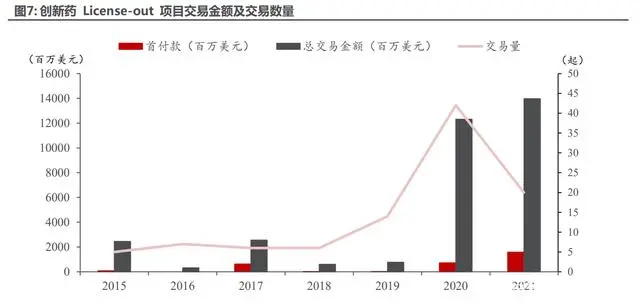
2021 年在此基礎上,再創(chuàng)海外授權高峰,雖然項目數(shù)為 20 項低于去年同期,但其中重磅 交易頻出,更是包含了百濟神州替雷利珠單抗、Ociperlimab 及榮昌生物維迪西妥單抗三起重磅 項目,首付款分別達到 6.5 億美元,2 億美元及 3 億美元。
2.3.2 海外臨床:出海尋求
海外臨床:2021 年同樣是中國海外臨床項目收獲的一年,共有 8 款創(chuàng)新藥上市申請獲美國 FDA 受理,其中包括傳奇生物 Cilta-cel CAR-T 療法,信達、君實、百濟、康方四款國產(chǎn) PD-1 等中美雙報項目。海外臨床不僅可以幫助企業(yè)適應美、歐等地監(jiān)管要求,打造臨床試驗隊伍,同 時在海外人群中驗證藥效有助于在 License-out 合作中獲取更高的首付款和里程碑條件。
3、醫(yī)療器械短期受集采波動,長期創(chuàng)新仍是主旋律
中國醫(yī)療器械行業(yè)正處于轉型期,中高端器械占比穩(wěn)步提升。國內醫(yī)療器械行業(yè)以中小型企 業(yè)為主,主要集中于低值醫(yī)用耗材等低附加值器械領域,這些小型國內企業(yè)主導著中低端市場。就高端器械而言,行業(yè)仍高度依賴于進口,由少數(shù)外資品牌主導。隨著帶國內醫(yī)療器械帶量集采 的范圍繼續(xù)擴大,以及新冠的催化,國產(chǎn)產(chǎn)品憑借性價比和供應鏈優(yōu)勢對進口產(chǎn)品逐步產(chǎn)生替代, 在過去 10 年里,國內品牌在高值耗材細分市場的份額已從約 20%增至約 30%。
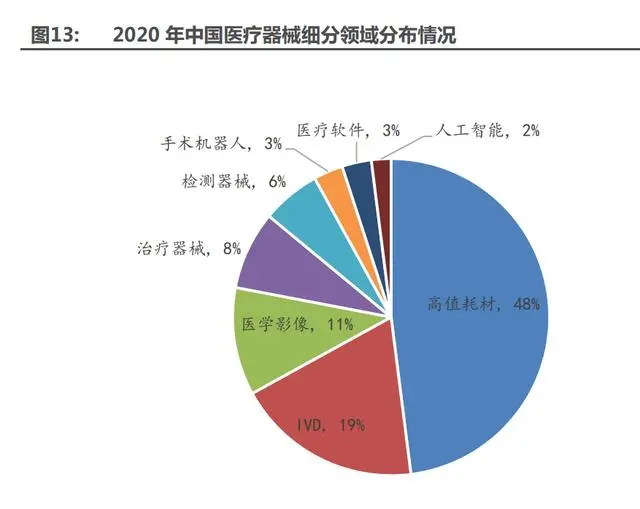
從細分領域來看,高值耗材占比高達 48%。隨著人口老齡化,醫(yī)保覆蓋范圍擴大,尤其是介 入類手術需求量增加,對高值醫(yī)用耗材的需求也相應增加。另一方面,進口替代和帶量采購等行 業(yè)政策也加速了國內高值醫(yī)用耗材企業(yè)創(chuàng)新發(fā)展。IVD 占比位居其次,占總數(shù)的 19%。包括基因測序、化學發(fā)光分析、微流控芯片核酸分析等試劑與設備,正在加速實現(xiàn)國產(chǎn)替代, 2020 年新冠疫情帶來的診斷檢測需求更加助推了 IVD 行業(yè)的增長。此外,醫(yī)學影像設備、治療器 械和檢測器械分別占比 11%、8%和 6%。
3.1 消費升級、政策鼓勵、資本青睞三架馬車,驅動創(chuàng)新醫(yī)械穩(wěn)步發(fā)展
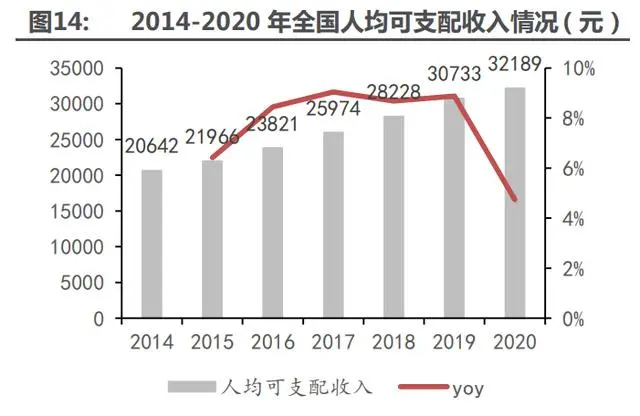
我國人均居民可支配收入和衛(wèi)生總費用支出逐年上升,醫(yī)療消費持續(xù)升級。隨著宏觀經(jīng)濟的 發(fā)展,我國居民可支配收入持續(xù)增長,居民消費能力大大提升,從而奠定了國內消費升級趨勢的 基調。其次,我國醫(yī)療衛(wèi)生費用投入不斷加大,居民健康水平持續(xù)改善。數(shù)據(jù)顯示,2015-2020 年我國衛(wèi)生總費用支出 CAGR 為 15.37%,約為同時期居民可支配收入 CAGR 的 2 倍,充分體現(xiàn) 了《健康中國 2030》的治國理念。
政策大力支持創(chuàng)新醫(yī)療器械發(fā)展。近年來國家出臺了鼓勵醫(yī)療器械的一系列政策,國家藥監(jiān) 局也隨之制定出一系列鼓勵醫(yī)械發(fā)展的文件,在深化審評審批制度改革的同時更加重視醫(yī)療器械 上市后的監(jiān)管,保障公眾用械安全有效。
資本青睞,醫(yī)療器械行業(yè)融資次數(shù)同比增長明顯。2021 年國內醫(yī)療器械融資熱度創(chuàng)歷史新高, 融資事件 488 起,同比增長 47.43%;融資規(guī)模為 558 億元,與 2020 年幾近持平;行業(yè)融資輪 次整體后移,C 輪和戰(zhàn)略投資階段項目數(shù)量明顯增加,一定程度上說明資本的目光更多聚焦在商業(yè) 模式相對成熟的項目上。(報告來源:未來智庫)
3.2 歷經(jīng)集采陣痛期,”創(chuàng)新器械”終將迎來柳岸花明
集采邊際趨緩,創(chuàng)新價值永恒。目前國內醫(yī)療器械集采正處于進行時,醫(yī)用耗材從價格 項目中逐步分離,發(fā)揮市場機制作用,實行集中采購、“零差率”銷售。2021 年,醫(yī)療器械的集 中帶量采購品類擴大,從高值耗材類逐步擴大至醫(yī)療設備,并進一步超預期延伸至此前普遍認為 的集采難度高、國產(chǎn)化率低、集采可能性較小的 IVD 化學發(fā)光領域,但今年集采降幅有所緩解, 安徽化學發(fā)光集采平均降幅不足 50%,保持了企業(yè)合理的利潤空間。因此短期來看,集采有助于 增厚國產(chǎn)產(chǎn)品的成本優(yōu)勢,加速國產(chǎn)替代;長期來看,在邊際成本遞減規(guī)律下,行業(yè)馬太效應或 將加劇,生產(chǎn)同質化產(chǎn)品且缺乏規(guī)模及成本控制優(yōu)勢的部分企業(yè)則將被淘汰出局,真正具備規(guī)模 效應和創(chuàng)新實力的公司將逐步顯現(xiàn),行業(yè)或將加速迎來低端產(chǎn)能出清的新格局。
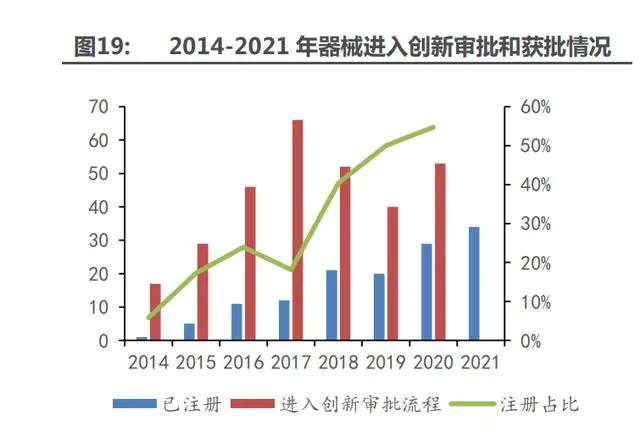
近年來國產(chǎn)醫(yī)療創(chuàng)新器械申報及獲批數(shù)目大幅增加。在高值耗材帶量采購等行業(yè)政策驅動下, 國內醫(yī)療器械行業(yè)正在進入創(chuàng)新時代。截至 2021 年 12 月底,國家級創(chuàng)新醫(yī)療器械產(chǎn)品也已經(jīng)達 到 133 項。從進入審批通道與完成注冊上市的比例來看,2014 年進入國家創(chuàng)新醫(yī)療器械審批程序 的產(chǎn)品數(shù)共 17 項,有 1 項完成產(chǎn)品注冊,比例僅為 5.9%。2020 年這一比例達到 54.7%,意味 著每兩項進入創(chuàng)新醫(yī)療器械審批程序的產(chǎn)品中,就有一項獲得產(chǎn)品注冊證,審批效率大幅上升。隨著國內創(chuàng)新醫(yī)療器械特別審批經(jīng)驗積累和流程優(yōu)化,在人工智能、醫(yī)療軟件以及手術機器人等 亟需實現(xiàn)國產(chǎn)替代的領域,創(chuàng)新產(chǎn)品的不斷涌現(xiàn)將成為常態(tài)化。
近年來,中國醫(yī)療器械國產(chǎn)化率加深。從 2017-2020 年的醫(yī)療器械國產(chǎn)化變化情況來看, 2017 年,國內僅有 518 項二級醫(yī)療器械產(chǎn)品國產(chǎn)化率超過 50%,到 2020 年,這一數(shù)字達到 881 項,增長了 70%。從進口醫(yī)械產(chǎn)品數(shù)量來看,2020 年,中國進口醫(yī)療器械產(chǎn)品共計 26713 件, 同比減少 6.65%;從中高端醫(yī)療器械細分產(chǎn)品來看,2020 年進口數(shù)量排名前三的分別是體外診斷 試劑、無源植入器械和口腔科器械,但從各自的進口數(shù)量來看,均較上年減少,并且減少數(shù)量均 在百件以上。
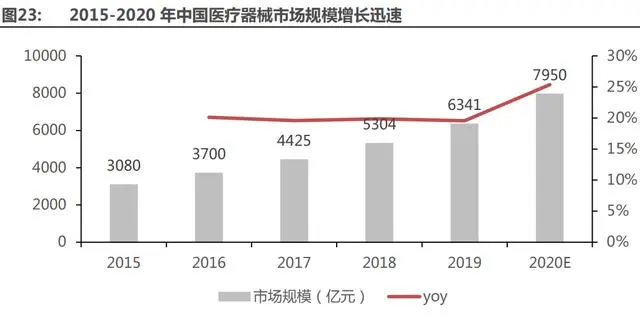
受益于經(jīng)濟水平的提升,健康需求不斷增加,中國醫(yī)療器械市場迎來了巨大的發(fā)展機遇。近 年來,我國醫(yī)療器械市場保持著穩(wěn)步增長。2019 年我國醫(yī)療器械行業(yè)市場規(guī)模約為 6341 億元,同比增長 19.55%。隨著我國醫(yī)療器械行業(yè) 的技術革新及產(chǎn)業(yè)鏈成熟,市場容量將會不斷擴大,加之疫情對我國醫(yī)療器械行業(yè)的巨大推動作 用。2020 年,我國醫(yī)療器械行業(yè)市場規(guī)模大約為 7950 億元。
未來醫(yī)療器械領域,我們看好由創(chuàng)新器械推動的應用領域。主要推薦 4 大細分”創(chuàng)新器械” 賽道:1)基因檢測,受益于基因技術進步、檢測成本下降,新型應用場景如腫瘤伴隨診斷和早篩 等不斷涌現(xiàn);2)人工心臟瓣膜,受益于抗鈣化技術不斷成熟,循證醫(yī)學數(shù)據(jù)不斷完備,推動國內 心臟瓣膜手術滲透率提升;3)內窺鏡:中國內窺鏡器械市場處于快速上升階段,行業(yè)增速遠高于 全球平均水平,弗若斯特沙利文預計到 2024 年市場規(guī)模將增長至 422.7 億元,目前仍以進口產(chǎn)品 為主,從技術壁壘、研發(fā)進程、商業(yè)化放量角度分析,預計硬鏡國產(chǎn)化率提升速度將高于軟鏡;4) CGM:CGM 在國內仍未被廣泛應用,隨著 2016 年雅培的產(chǎn)品獲批,國內 CGM 行業(yè)正式進入快 速商業(yè)化放量階段。預計 2020 年行業(yè)總規(guī)模約 6 億元,隨著我國糖尿病患者健康管理意識增強, 相關產(chǎn)品研發(fā)有序推進及商業(yè)化放量加速,2030 年國內 CGM 市場有望超百億。
3.2.1 基因檢測藍海賽道,引領醫(yī)學新時
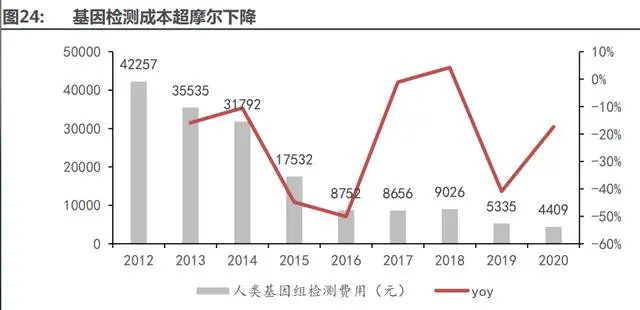
(1)供給端:技術進步,檢測成本超摩爾定律下降
基因測序技術已發(fā)展至第四代。從 1977 年第一代 DNA 測序技術(Sanger 法),發(fā)展至今三十多年時間,測序技術已取得了相當大的發(fā)展,從第一代到第二代到第三代乃至第四代,測序讀 長從長到短,再從短到長。但就當前形勢看來第二代短讀長測序技術在全球測序市場上仍然占有 著絕對的優(yōu)勢位置。測序技術的每一次變革,也都對基因組研究、疾病醫(yī)療研究、藥物研發(fā)、育 種等領域產(chǎn)生巨大的推動作用。
(2)應用端:新的應用場景不斷涌現(xiàn)
1) 產(chǎn)前檢測必要性和重要性大幅提升
隨著生育年齡增長、工作壓力加大等原因,產(chǎn)前檢測的重要性和必要性在大幅度提升。一方 面,育齡婦女規(guī)模已見頂下滑,生育年齡在 20~29 歲的女性數(shù)量正在逐年減少,另外社會整體教 育時間變長,使得平均生育年齡不斷增大。另一方面,男性生育能力影響二孩數(shù)量。浙江省人類 精子庫的數(shù)據(jù)顯示,近年到精子庫捐精的男性,精液質量連年下降,每毫升精液里的平均精子數(shù) 由 2005 年的 1.3 億左右,下降到 2015 年的 0.67 億,會向前運動可能與卵子結合的精子所占百 分比由 2005 年的 56.5%下降到 2015 年的 51.6%。在現(xiàn)代社會中,電磁輻射、食品中的雌激素 和塑化劑、抽煙酗酒、長期穿緊身褲和泡溫泉,都影響著男性生育能力和精子質量。
2) 伴隨診斷:給腫瘤患者治療提供重要評估手段
對腫瘤患者而言,伴隨診斷可以評估最適合的特定療法。美國一項研究表明,針對不同適應 癥,有伴隨診斷共同使用的靶向藥客觀緩解率遠高于無伴隨診斷的靶向藥,從而可以減少無效治 療,避免浪費晚期癌癥患者寶貴的治療時間,同時也為患者規(guī)避了無效治療產(chǎn)生的高昂費用。對 于藥企而言,伴隨診斷可以增加新藥的研發(fā)成功概率,從而降低臨床試驗成本。
3) 癌癥早篩:有效提升生存率與降低治療成本
癌癥早篩必要性和可行性強。1)必要性:大部分腫瘤患者檢出已是中晚期,可通過早篩提高 早期癌癥患者比例,盡早進行治療,從而大幅提高 5 年生存率。中國目前癌癥死亡率遠高于發(fā)達 國家,對標美國,其癌癥總體發(fā)病人數(shù)約為中國的一半,但其癌癥死亡人數(shù)只有中國的 1/3-1/4, 主要是由于癌癥早篩普及較早。2)可行性:對于個人而言,癌癥的早篩早診可大大減少患者的 經(jīng)濟負擔。由于早期發(fā)現(xiàn)癌癥可以選擇手術切除而不是藥物治療,或者使用標準的一線藥物 而不是更昂貴的實驗方案,從而大幅降低治療成本,而且,患者在治愈之后可以繼續(xù)工作, 給家庭帶來收入。根據(jù)弗若斯特沙利文,在轉移階段被診斷出的癌癥患者預估平均治療費用 比在早期階段診斷的癌癥患者高出兩倍。
預計 2030 年癌癥早篩市場可達近千億元。1)腸癌早篩:根據(jù)弗若斯特沙利文,2019 年腸 癌高危人群數(shù)目約 1.2 億人,中風險人群數(shù)目約 6.33 億人,預計 2030 年將分別增長至 1.6 億人 和 7.58 億人。預計 2030 年在中風險人群中滲透率約 5%,高風險人群中滲透率約 40%,其中選 擇 FIT-DNA 基因檢測項目進行腸癌早篩的患者數(shù)目占比約 10%,由此計算得到 2030 年中國的腸 癌早篩中基因檢測市場規(guī)模約 83 億元;2)肝癌早篩:肝癌高危人群每年需要做 2 次血清 AFP 和 肝臟超聲檢查,不考慮滲透率的前提下,傳統(tǒng)肝癌篩查市場空間約為 351 億元。目前國內還沒有 成熟的可大規(guī)模應用于臨床的肝癌早篩基因檢測產(chǎn)品,商業(yè)化進程會略晚于腸癌早篩產(chǎn)品。預計 2021 年有望在臨床上進行推廣,到 2030 年國內肝癌早篩市場規(guī)模約 193 億元。3)泛癌早篩:預計 2030 年 50-75 歲人口數(shù)目約為 5.10 億人次,假設 2030 年泛癌早篩產(chǎn)品價格降低至 2500 元/次,滲透率為 5%,則市場規(guī)模高達 638 億元。

3.2.2 心臟瓣膜研發(fā)正有序推進,介入瓣打開市場想象空間
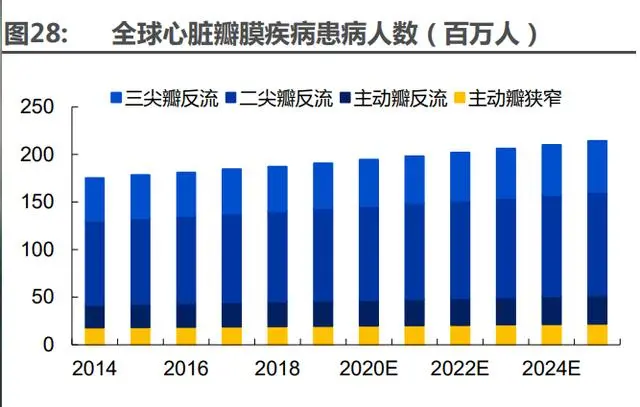
全球及中國范圍內瓣膜性心臟病負擔日益加重,且集中在主動脈瓣和二尖瓣病變。據(jù)測算, 2018 年,全球有約 2.1 億瓣膜性心臟病患者,造成約 260 萬人死亡。全球范圍內分別有 1930 萬 人、2600 萬人患有主動脈狹窄或主動脈反流,中國的患病人數(shù)分別為 420 萬、380 萬。隨著人口 老齡化的加劇,主動脈狹窄或反流的患者呈上升趨勢。相比主動脈瓣的病變,二尖瓣疾病的發(fā)病 率更高,2018 年全球和中國的二尖瓣反流患者分別為 9510 萬和 1030 萬人。因此人工瓣膜的更 換需求主要集中在主動脈瓣和二尖瓣病變的患者中。
介入瓣有望迅速放量,中長期會與外科瓣并存。目前國內人工外科生物瓣市場仍由愛德華、 美敦力等外企占據(jù)主要份額,佰仁憑借優(yōu)異的產(chǎn)品性能、更為適中的產(chǎn)品價格有望進一步提高市 占率。介入瓣因其創(chuàng)傷小、手術風險相對較小以及恢復時間快未來有望迅速放量,但外科瓣價格 相對較低、循證醫(yī)學時間長以及覆蓋的適應癥種類較為豐富,因此,未來 5-10 年,人工心臟瓣膜 市場仍會處于是外科瓣和介入瓣并存的狀態(tài)。
3.2.3 內窺鏡技術壁壘高,進口替代是國內企業(yè)發(fā)展主邏輯
中國內窺鏡器械市場處于快速上升階段,行業(yè)增速遠高于全球平均水平。2015 年中國內窺鏡市場在全球市占率僅有 12.7%,2019 年中國內窺鏡市場規(guī)模達 225.1 億人民幣,全球市占率 提升至 16.0%,遠高于全球內窺鏡市場同期增速。由于國內企業(yè)技術水平不斷提升,我們預計內 窺鏡行業(yè)國產(chǎn)替代進程將加速,預計到 2024 年,其市場規(guī)模將增長至 422.7 億元從產(chǎn)品類型來 看,中國內鏡市場主要分為硬鏡(腹腔鏡等)、軟鏡(主要是胃腸鏡)以及配套設備和耗材。
國內硬鏡市場以進口為主,國產(chǎn)替代是行業(yè)主邏輯。中國硬鏡主要分為白光硬鏡和熒光硬鏡, 市場參與主體以歐美和日本等進口廠家為主,呈相對集中的狀態(tài),其中排名前三的企業(yè)分別為卡 爾史托斯、奧林巴斯及史賽克,合計市場占比超 70%。
預計熒光硬鏡是未來的主流方向。熒光硬鏡市場由于其核心光學技術水平要求較高,進入中 國市場時間較晚,2019 年僅有兩家公司競爭,呈現(xiàn)寡頭格局。未來由于熒光內窺鏡設備兼具白 光和熒光的兩種模式的顯影能力,對于醫(yī)院而言,可以一機多用,因此將更有意愿采購熒光產(chǎn)品, 預計熒光產(chǎn)品將對白光產(chǎn)品產(chǎn)生替代關系。
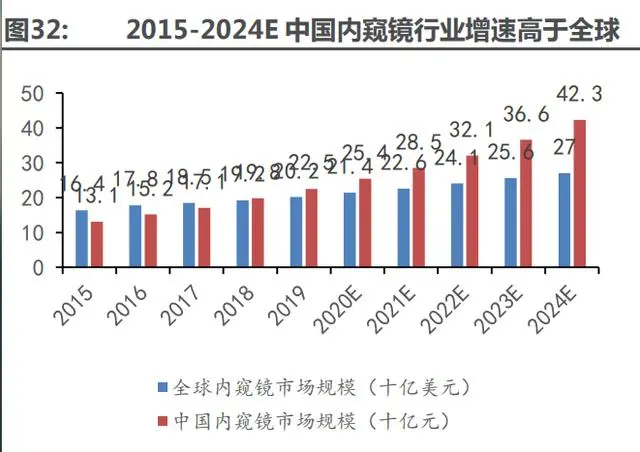
軟鏡技術壁壘高于硬鏡,國內市場仍以進口產(chǎn)品為主。軟性內鏡通過人體的自然腔道來完成 檢查、診斷和治療,主要應用在消化道領域,隨著早癌篩查的普及和內窺鏡新術式的開展,未來 國內軟性內鏡市場將繼續(xù)保持較快增長,預計到 2025 年銷售額將達到 81.2 億元。
3.2.4 高基數(shù)糖尿病患者帶來 CGM 行業(yè)高增長,預計 2030 年市場規(guī)模超百億
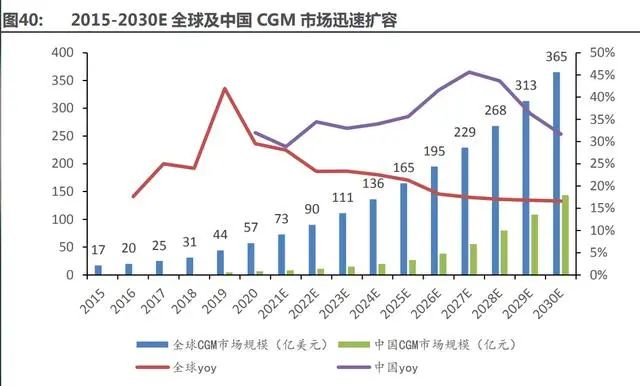
數(shù)量龐大的糖尿病患者為糖尿病持續(xù)監(jiān)測市場持續(xù)帶來高增長。據(jù)灼識咨詢統(tǒng)計,目前全球 約有 4.63 億糖尿病患者,受到人口老齡化、飲食不健康、城市化加速、運動量少等因素影響, 預計 2045 年全球糖尿病患者人數(shù)將接近 7 億人。而中國是全球糖尿病患者數(shù)量第一大國,根據(jù) IDF,截至 2019 年,中國糖尿病患者人數(shù)高達 1.16 億人,占全球患者的 25.1%,目前我國共有 1312 萬人有必要使用連續(xù)血糖監(jiān)測產(chǎn)品,龐大的患者基數(shù)將支撐 CGM 廣闊的市場空間,2030 年市場規(guī)模將達到 143 億元。
我國 CGM 市場目前仍處于發(fā)展初期,“玩家”數(shù)量較少,進口產(chǎn)品占據(jù) 80%以上的市場份 額。截至 2021 年 12 月,整個市場以 2 家外資廠商(雅培、美敦力)和五家較小體量的國產(chǎn)廠 商構成,且中國 CGM 市場集中度較高,僅雅培一家就占據(jù)了整個市場約 80%的市場份額,美 敦力和其他國產(chǎn)廠商市場份額之和才僅為約 20%。2016 年,雅培和美敦力的 CGM 雙雙獲批, 拉開了我國 CGM 行業(yè)發(fā)展的序幕,隨后,美奇、圣美迪諾、普林斯頓、上海移宇等國產(chǎn)品牌紛 紛涌現(xiàn),2021 年,伴隨著凱立特(于 2021 年 9 月被魚躍醫(yī)療收購)、微泰醫(yī)療和深圳硅基等的 CGM 產(chǎn)品陸續(xù)獲批上市,國內 CGM 市場格局有望重塑。
4、新制造:”CXO”景氣度仍然向上,新賽道不斷涌現(xiàn)
4.1 “CXO”:景氣向上,板塊仍兼具確定性與成長性
4.1.1 景氣→趨勢:創(chuàng)新基調恒久不變,新熱點帶來新外包機遇
變與不變,兩大層次三個維度前瞻性跟蹤”CXO”行業(yè),精準挖掘子領域投資機遇。首先, 不變的是:創(chuàng)新基調恒久不變,外包需求穩(wěn)定增長,因此,研發(fā)階段的研發(fā)支出和商業(yè)化階段的 藥品銷售額每年以恒定增速成長。變化的是:需深度跟蹤外包滲透率和中國 CRO/CDMO 全球 市占率這兩個變化維度,精準挖掘子領域潛在投資機遇。
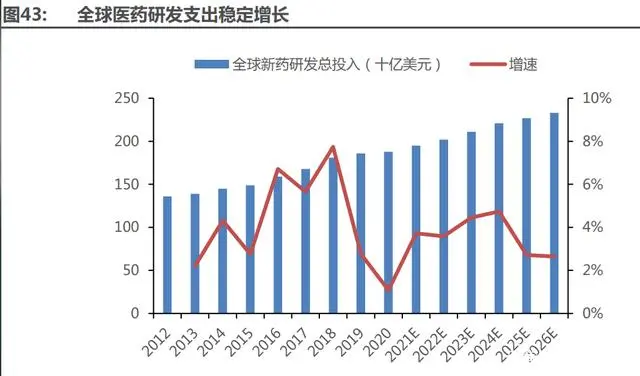
研發(fā)支出:新藥研發(fā)支出穩(wěn)定增長。全球制藥企業(yè)的總研發(fā) 投入呈穩(wěn)定增長態(tài)勢,預計 2026 年高達 2330 億美元,2019-2026 年的年均復合增速為 3.2%。
從藥物時代浪潮去看,歷經(jīng)小分子化藥-大分子生物藥-細胞基因治療三個世代,外包服務商 快速跟上藥物研發(fā)的新熱點,外包滲透率隨之上升,打開長期成長空間。
1)1980 年-至今,第一世代的小分子化藥 CDMO 服務商逐步誕生,1982 年 Lonza 和昆 泰成立,小分子化藥”CXO”歷經(jīng)了 40 余年的發(fā)展,全球外包增速維持在 4%-5%,但是由于 小分子化藥占據(jù) 70%-80%的外包市場,因此其市場空間非常廣闊。
2)2010 年-至今,第二世代的大分子生物藥 CDMO 服務商逐步成立,1996 年 Lonza 開 始搭建生物藥平臺,2011 年三星生物和藥明生物相繼成立,經(jīng)過十余年的快速發(fā)展,生物藥外 包市場以 11%-13%增速繼續(xù)成長。
3)2017 年-至今,第三世代的細胞基因治療 CDMO 嶄露頭角,全球首個 CAR-T 藥物于 2017 年獲批上市,帶動整個市場對細胞基因療法的高關注度,Lonza 在 2010 年開始搭建病毒 載體平臺;2014 年,藥明康德在美國費城新建生產(chǎn)工廠,進行 CAR-T 及相關癌癥免疫細胞療法 領域研發(fā)生產(chǎn);2018 年,博騰股份細胞基因治療子公司博騰生物成立,處于興起初期,細胞基 因治療外包市場以 15%的增速快速成長。
質量體系得到規(guī)范市場高度認可,中國制造具全球品牌知名度。從 FDA 披露數(shù)據(jù)看,全球 通過 FDA 資格認證的工廠數(shù)量前三名分別是:美國(12804)>印度(1644)>中國(1090), 另外,從 2008 年開始,中國每年通過 FDA 審計的工廠數(shù)目占當年全球的比例逐步提升,2016 年達到 8.7%,2020 和 2021 年由于疫情限制出差,F(xiàn)DA 減少了在全球范圍內的審查頻次。
CMO 向 CDMO 的演變:產(chǎn)業(yè)升級,壁壘抬高,毛利改善。
客戶綁定耗時長:往往合作雙方需要經(jīng)過 10 年左右的合作與磨合才有可能在業(yè)務能力和知 識產(chǎn)權保護上達成互信,形成戰(zhàn)略合作伙伴關系。
技術積累與團隊建設不能一蹴而就:如何順利實現(xiàn)藥品或中間體的工業(yè)化生產(chǎn),并在此基礎 上進行優(yōu)化是 CDMO 公司長期的追求。而化學反應的細節(jié)處理和新技術應用需要在長期生 產(chǎn)過程中摸索總結,不能一蹴而就。
EHS 管控強度提升,提高進入壁壘:隨著國內 EHS 管控強度的提升,項目審批的時間和難 度也在逐步提升。有些企業(yè)已做好了技術儲備但苦于項目沒有得到及時審批而錯失商機。

4.1.2 復盤→分化:結構性機會或將是明年”CXO”行業(yè)投資主旋律
我們認為 2021 年”CXO”板塊行情可劃分為 4 個階段,其中,年初和年中均在業(yè)績加速預 期下表現(xiàn)出較好的上升趨勢;下半年在資金風格、政策及謠傳的美國實體清單三重因素影響下, 引發(fā)市場對”CXO”行業(yè)景氣度的擔憂。
第一階段(01.07-02.14):2020 Q4 和 2021 Q1 業(yè)績加速預期提振行業(yè)景氣度,估值隨之 拔高。特色 CDMO 漲幅排在首位,得益于 2021 年 Q1 康龍化成和藥石科技優(yōu)異的業(yè)績表 現(xiàn),歸母凈利潤分別同比增長 142%和 147%。
漲幅排序為:特色 CDMO(60.41%)>創(chuàng)新藥 CRO(51.70%)>二線 CDMO(44.50%) >一線 CDMO(37.17%)>臨床 CRO(14.33%)。
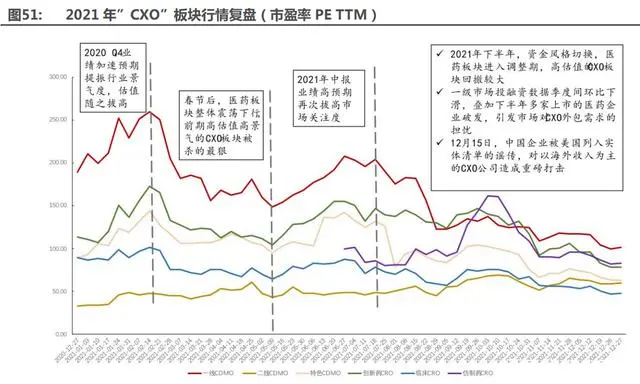
第二階段(02.21-05.09):春節(jié)后,醫(yī)藥板塊整體震蕩下行,前期高估值高景氣的”CXO” 板塊回調最多。跌幅排序為:一線 CDMO(-40.76%)>創(chuàng)新藥 CRO(-37.22%)>臨床 CRO(-33.80%) >特色 CDMO(-25.02%)>二線 CDMO(-7.81%)。
第三階段(05.16-07.18):2021 年中報業(yè)績高預期再次拔高市場關注度,但是,7 月 2 日 國家藥品審評中心 CDE 發(fā)布《以臨床價值為導向的抗腫瘤藥物臨床研發(fā)指導原則》征求意 見稿,引發(fā)市場對”CXO”景氣度的質疑,導致整體板塊略微波動。
漲幅排序為:一線 CDMO(32.34%)>特色 CDMO(27.79%)>創(chuàng)新藥 CRO(26.82%) >二線 CDMO(5.30%)。
第四階段(07.25-12.27):三重因素導致板塊的集體回撤。1)2021 年下半年,資金風格 切換,醫(yī)藥板塊進入調整期,高估值的”CXO”板塊回撤較大;2)一級市場投融資數(shù)據(jù)季 度間環(huán)比下滑,疊加下半年多家上市的醫(yī)藥企業(yè)破發(fā),引發(fā)市場對”CXO”外包需求的擔 憂;3)12 月 15 日,中國企業(yè)被美國列入實體清單的謠傳,對以海外收入為主的”CXO” 公司造成重磅打擊。其中二線 CDMO 和仿制藥 CRO 在行業(yè)下行階段,走出獨立行情,二 線 CDMO 上漲 26.13%,仿制藥 CRO 陽光諾和 6 月 21 日登陸資本市場以來,最大漲幅達 到 100.75%。
跌幅排序為:特色 CDMO(-50.17%)>一線 CDMO(-46.61%)>創(chuàng)新藥 CRO(-43.78%) >臨床 CRO(-34.63%)。
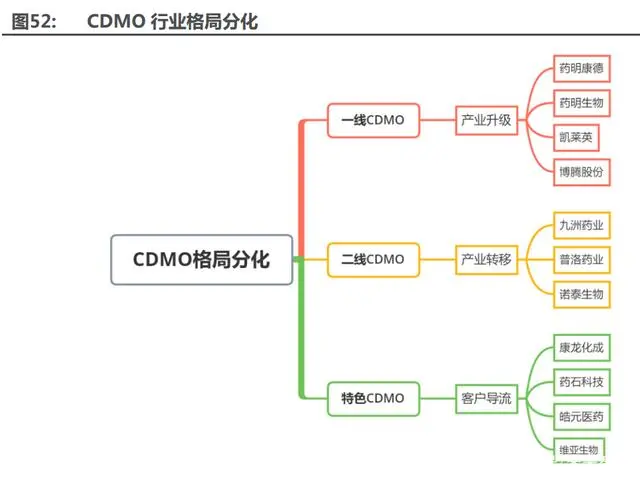
CDMO 子板塊格局分化,成長邏輯各不相同。我們從發(fā)展階段、體量規(guī)模、成長邏輯及公 司地位四個維度將 CDMO 板塊劃分為三個子板塊:
1)一線 CDMO:包括藥明康德、藥明生物、凱萊英及博騰股份,這 4 個公司業(yè)務板塊布 局完善,無論從公司質地、客戶質量及品牌知名度處于國內第一梯隊,國際領先地位。產(chǎn)業(yè)升級 為其成長主旋律,一線 CDMO 全球地位明顯提升,明年有望迎接新元年。
2)二線 CDMO:包括九洲藥業(yè)、普洛藥業(yè)及諾泰生物等,二線 CDMO 公司擁有足夠的產(chǎn) 能和豐富的生產(chǎn)經(jīng)驗,原先主營業(yè)務以大宗”原料藥”等為主,逐步向附加值更高的 CDMO 業(yè) 務拓展,提升公司整體毛利率和凈利率。產(chǎn)業(yè)轉移,享受訂單外溢 β 行情,二線 CDMO 迎來發(fā) 展新機遇。
3)特色 CDMO:包括康龍化成、藥石科技、皓元醫(yī)藥及維亞生物,這 4 家公司均是以早 期實驗室服務蓄積客戶流量,從臨床前階段就切入客戶管線,客戶粘性強,通過自建產(chǎn)能或者收 購現(xiàn)有產(chǎn)能,打造研發(fā)-生產(chǎn)一體化服務產(chǎn)業(yè)鏈。因此,前端業(yè)務積蓄客戶流量,后端生產(chǎn)逐步 放量,特色 CDMO 彈性最大。
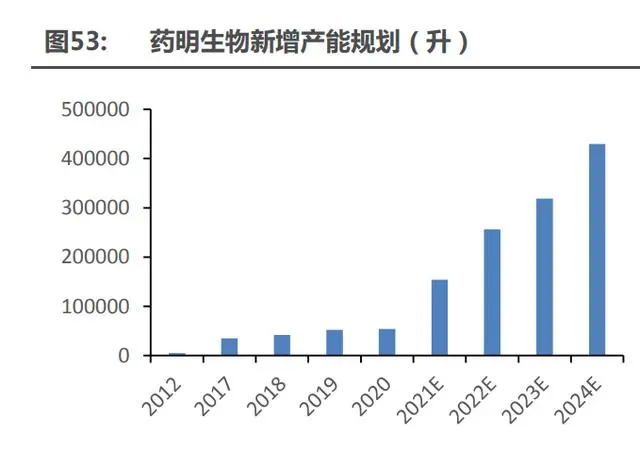
產(chǎn)能釋放節(jié)奏高度匹配訂單需求,一線 CDMO 明年或將迎來業(yè)績爆發(fā)期。一線 CDMO 企 業(yè)大都在 2000 年左右成立,早期處于拓市場、建口碑時期,多以接附加值較低的中間體或原料 藥訂單為主,以產(chǎn)業(yè)鏈轉移為行業(yè)增長邏輯。歷經(jīng) 20 余年的發(fā)展,我們認為站在當下,一線 CDMO 企業(yè)的成長邏輯已轉變成產(chǎn)業(yè)升級,不再是低附加值的 CMO 訂單轉移,而是運用核心 技術主導工藝開發(fā)的高附加值 CDMO 訂單。后疫情時代的新冠口服藥訂單吹響產(chǎn)業(yè)升級的號角, 中國 CDMO 企業(yè)被海外大藥企納入創(chuàng)新藥商業(yè)化供應的第一梯隊名單,同時,中國 CDMO 企業(yè)的產(chǎn)能釋放節(jié)奏也高度匹配訂單需求。凱萊英預計到 2022 年,產(chǎn)能增加至 5870m,是現(xiàn)有 產(chǎn)能的 2 倍,位居國內首位;藥明康德(合全藥業(yè))預計到 2023 年,產(chǎn)能增加至 3886m,是 現(xiàn)有產(chǎn)能的 2.7 倍;博騰股份預計到 2022 年,產(chǎn)能增加至 2000m,是現(xiàn)有產(chǎn)能的 1.4 倍。作 為國內生物藥 CDMO 龍頭,在新冠疫情突發(fā)之時,藥明生物快速響應市場需求,僅 2020 年, 就交付了 800 多公斤的新冠中和抗體,以高交付質量在全球建立良好口碑,未來幾年藥明生物 的產(chǎn)能也在加速落地,2022 年即將具備 25.6 萬升產(chǎn)能,是現(xiàn)有產(chǎn)能的 1.6 倍。
實驗室服務是中國強項,”CXO”企業(yè)自此衍生兩類業(yè)態(tài)。實驗室服務是中國”CXO”企 業(yè)最先受到海外藥企青睞的業(yè)務板塊,并開創(chuàng)了中國特色的 follow the molecule 商業(yè)模式,積 蓄早期大量優(yōu)質客戶流量池,藥明康德、康龍化成、美迪西、昭衍新藥等成立之初都是以實驗室 服務切入客戶項目管線,扎穩(wěn)根基。我們將實驗室服務劃分為兩個子領域:
創(chuàng)新藥為主,仿制藥為輔的綜合及細分特色 CRO:綜合性 CRO 公司主要包括藥明康德、 康龍化成和美迪西,能夠為客戶提供創(chuàng)新藥綜合化服務。成立時間較早,業(yè)務綜合性較強, 實驗室分布較廣。細分特色 CRO 公司分為藥物發(fā)現(xiàn)、安全性評價和模式動物三個小模塊, 其中藥物發(fā)現(xiàn)階段外包滲透率極低,僅為 10%,后端的臨床及生產(chǎn)環(huán)節(jié)外包滲透率約為 40%, 給相應外包服務商留下了很大拓展空間,主要包括成都先導和維亞生物;安全性評價是臨床 外包滲透率最高的環(huán)節(jié),約 55%,是實驗室服務中壁壘較高的環(huán)節(jié),國家要求所有從事藥 物研發(fā),企業(yè)和科研機構的實驗數(shù)據(jù)必須來自達到 GLP 標準并且被認可的實驗室,目前有 資格的”CXO”公司數(shù)量有限,主要包括昭衍新藥;隨著南模生物和集萃藥康登陸二級資 本市場,帶來全新模式生物賽道,以提供科研研究中剛需且基本外購為主的小鼠等動物。
仿制藥大國向仿制藥強國的升級,我國高端仿制藥研發(fā)服務仍然存在較大市場增長空間。雖 然我國仿制藥整體市場規(guī)模廣闊,但還不是仿制藥的強國,仿制藥質量還需進一步提升。根據(jù) CDE 數(shù)據(jù),在我國已有的 18.9 萬個藥品批準文號中,仿制藥占比達到 95%以上。結合集采制度、仿制 藥一致性評價制度,MAH 制度對于鼓勵藥品創(chuàng)新,提升仿制藥質量,促進我國仿制藥研發(fā)由低端 向高端轉變具有重要意義。
高質量、高端仿制藥的開發(fā)更加需要借助 CRO 企業(yè)的力量。為了形成差異化競爭優(yōu)勢,制 藥企業(yè)加大對高質量、高端仿制藥的研發(fā)投入力度,比如說緩控釋制劑、吸入性制劑、微球和脂 質體等。而且為了快速搶占市場份額,制藥企業(yè)希望在創(chuàng)新藥即將或者剛過專利期,就能夠實現(xiàn) 快仿、首仿。高質量、高端仿制藥的開發(fā)難度往往更大,資金投入更大,制藥企業(yè)更加需要借助 CRO 企業(yè)的力量,進一步促進了仿制藥 CRO 市場的發(fā)展。
臨床 CRO 市場規(guī)模處于所有外包子板塊的首位,龐大市場空間足以容納多家公司并行發(fā)展。弗若斯特沙利文預計,到 2024 年,全球臨床 CRO 市場規(guī)模有望高達 622 億美元,按照地區(qū)劃 分的全球臨床 CRO 增速來看,中國 2019-2024 年復合增長率為 30%,以超高速增長率逐步搶 占一定市場份額。
中國全球多中心臨床點和首次注冊臨床試驗地點選擇中國的項目數(shù)量顯著增長。2019 年在 中國進行的國際多中心臨床試驗總數(shù)為 156 個,占全球總數(shù)比例約為 20%。另外 2020 年,首 次注冊臨床試驗的地點選擇中國的項目數(shù)有 2953 個,占全球比例為 19%。(報告來源:未來智庫)
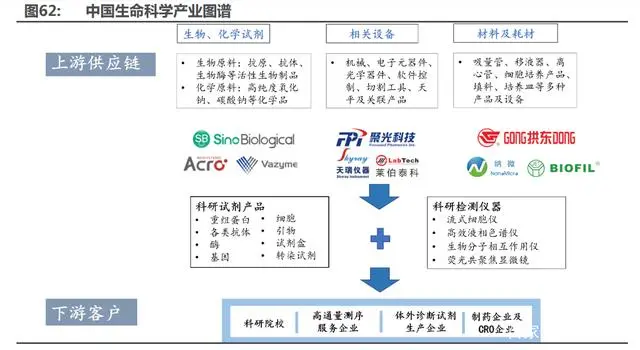
4.2 “生命科學產(chǎn)業(yè)鏈”與”制藥裝備”:未來十年的高光賽道
“生命科學產(chǎn)業(yè)鏈”上游主要包括生化試劑、設備和耗材。1)生化試劑:化學試劑由于技術、 生產(chǎn)壁壘低,國產(chǎn)產(chǎn)品具備價格優(yōu)勢,已基本實現(xiàn)進口替代;生物試劑系國內起步較晚,目前國 內進口產(chǎn)品市占率約 80%,隨著產(chǎn)品質量進一步優(yōu)化、種類進一步豐富,國產(chǎn)替代正加速進行, 相關公司有諾唯贊、百普賽斯、義翹神州和菲鵬生物。2)設備:大多屬于高精尖設備,目前國內 基本采用進口產(chǎn)品,但不乏優(yōu)秀廠家,正進行相關技術的突破和整機生產(chǎn),未來有望占據(jù)一席之 地,相關公司有東富龍和楚天科技;3)材料及耗材:低值實驗室耗材已基本實現(xiàn)國產(chǎn)自給,部分 核心材料如納米微球亦已開始進行國產(chǎn)替代,相關公司有納微科技。
政策扶持帶動行業(yè)規(guī)范高速發(fā)展。自 2016 年起,國家層面把加強大型科學儀器設備、實驗動 物、科研試劑、創(chuàng)新方法等保障研究開發(fā)的科研條件建設納入《“十三五”國家創(chuàng)新規(guī)劃》,之后 每年均會發(fā)布相關的意見或規(guī)劃以加強基礎科研建設。這表明政府對科研投入的重視,我國正努 力躋身世界一流科研水平。
中國在生命科學領域投入資金 CAGR 遠高于全球平均。2020 年全球生命科學研究投入資金 1601 億美元,中國生命科學投入資金 948 億元,約占全球投入總額的 9.2%,跟歐美發(fā)達國家相 比仍有較大差距。從成長性來看,中國生命科學研究資金 5 年(2016-2021)CAGR 為 16.32%, 全球同時期的 5 年 CAGR 為 6.27%,我國資金投入增速遠超全球平均水平,體現(xiàn)我國生命科學領域正處在快速成長期。未來在國家政策積極鼓勵基礎研究及資本持續(xù)賦能的推動下,我們認為資 金投入仍有望保持 10%+的增速。
4.2.1 生物試劑發(fā)展方興未艾,劍指星河
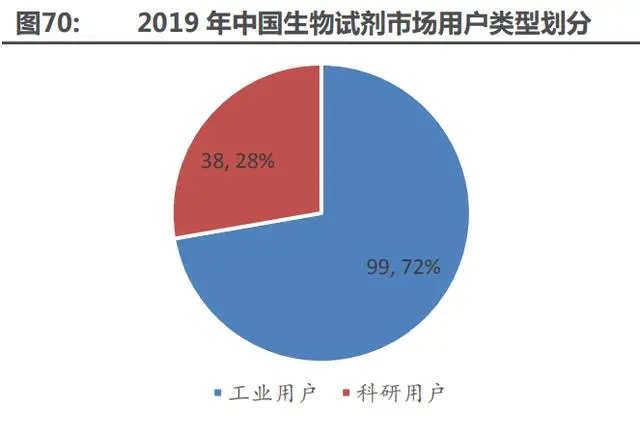
按生物科研試劑的用戶類型劃分,可以分為工業(yè)用戶和科研機構用戶兩類。工業(yè)用戶一般使 用生物科研試劑進行產(chǎn)品檢測或研發(fā);科研機構一般使用生物科研試劑進行教學或科學項目研究, 對生物科研試劑的檢測效率、準確度和質量標準要求較高。2019 年,以生物科研試劑投入資金計 算,我國科研機構用戶占比為 72.4%,工業(yè)用戶占比為 27.6%。按生物科研試劑的類別來劃分, 可以分為分子類、蛋白類和細胞類三大類別,三者的市場規(guī)模占比約為 5:3:2。
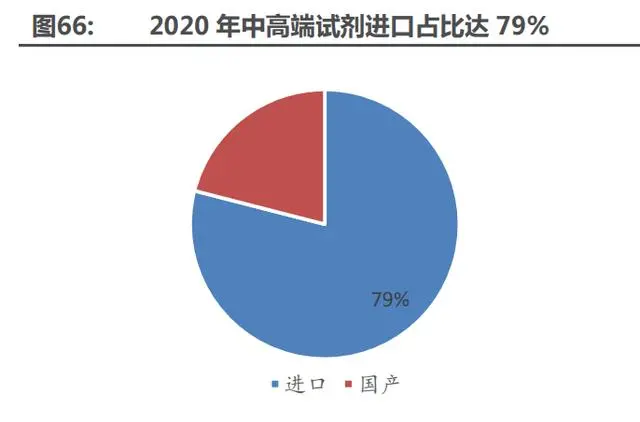
預計 2023 年中國生物科研試劑可達 260 億元,中高端生物試劑仍以進口為主,國內企業(yè) 因規(guī)模較小競爭格局較為分散。生物試劑目前由國外企業(yè)主導,國產(chǎn)企業(yè)起步較晚,技術和品牌 弱,市場份額較小,缺乏規(guī)模效益,且客戶分布廣且分散,平均訂單量小,難以批量實現(xiàn)產(chǎn)品生 產(chǎn)和流通。
生命科學領域的蓬勃發(fā)展為生物科研試劑市場帶來活力。生命科學研究資金投入的增加為生 物試劑行業(yè)的發(fā)展提供了良好支撐,生物試劑行業(yè)占生命科學領域整體資金投入的比重約 10-15%。相較于全球,中國生物科研試劑發(fā)展較晚,但近年來保持高速增長態(tài)勢,2015-2019 年 CAGR=17.1%,遠高于全球同期的 8.1%。
技術進步推動生物試劑需求增長。上個世紀 60 年代起,陸續(xù)出現(xiàn)了流式細胞術、酶聯(lián)免疫吸 附測定法、免疫印跡法、酶聯(lián)免疫斑點法等技術,這些實驗技術與方法學的成熟,衍生了大量對 配套生物試劑的需求。隨著 2000 年第二代高通量測序技術的面世,相應的高通量測序建庫試劑也 開始出現(xiàn)大量需求。近年來,隨著 CRISPR 技術的應用,Cas9 核酸酶試劑盒開始推出。未來,隨 著生命科學領域新技術的不斷發(fā)展,相應配套的生物試劑需求將會不斷擴大,生物試劑市場規(guī)模 也將隨之不斷擴大。
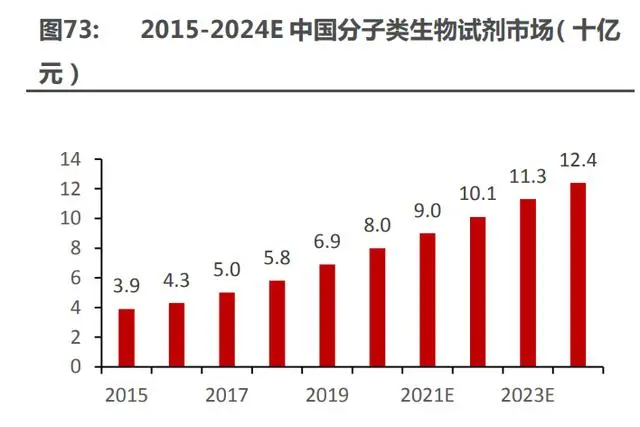
據(jù)沙利文數(shù)據(jù),分子類生物試劑應用場景豐富,預計 2024 年市場規(guī)模超百億。分子類生物 試劑主要指核酸以及小分子進行的實驗中所需的試劑類型,其中以各種分子生物學酶為主,比 如 PCR/qPCR 系列、逆轉錄酶、內切酶、修飾酶、克隆/點突變等。分子類生物試劑被廣泛應 用于科學研究、高通量測序、體外診斷、生物醫(yī)藥、動物檢疫等領域,應用延展性強。同時,各 細分領域市場規(guī)模增長迅速,帶動分子類生物試劑的需求迅速增長。
2019 年分子類生物試劑市場規(guī)模約 69 億元,分子類生物科研試劑規(guī)模預計在 2019-2024 年將以 CAGR=12.3%的速度增長,在 2024 年將達到 124 億元。目前國內分子類試劑競爭格局較 為分散,諾唯贊占據(jù)國內龍頭地位,占比約 4%,剩余 55%的市場份額多為國內其余體量較小的 試劑生產(chǎn)公司割據(jù),整體來說市場集中度不高,行業(yè)有待重新整合。其次進口占比較高,四大外 資企業(yè)如美國賽默飛、德國凱杰、羅氏 Takara 和美國 BioRad 合計市場占有量達 41%,但由于國 際形勢變化、匯率波動等因素,進口產(chǎn)品存在價格上漲及供貨緊張的風險,2020 年全球范圍內傳 播的新冠疫情進一步加劇了生物試劑的供應緊張,供應鏈本地化越來越受到國內科研機構及企業(yè) 的重視,我國生物試劑行業(yè)得到前所未有的發(fā)展機遇。
蛋白類生物試劑賽道小而美,增長動力足。重組蛋白是指用特定基因的 DNA 序列作為模板 表達生成的蛋白質。根據(jù)作用機理可大致分為重組蛋白和抗體,抗體指可以與康團特異性結合的 免疫球蛋白,占比較高,約 2/3,主要用于免疫反應。
重組蛋白在生物藥研發(fā)、基礎研究和體外診斷試劑方面均有廣泛應用。2019 年全球銷售額前 10 名的藥物中,7 款是生物藥,包括單克隆抗體、融合蛋白。單克隆抗體藥物的市場需求巨大, 而重組蛋白是研究單克隆抗體藥物的重要試劑之一;在科學研究中,重組蛋白可應用于結構解析、 細胞培養(yǎng)、細胞誘導、分化、酶功能性研究、底物、對照品等多個方面;診斷試劑成本的 60%-80% 是包括診斷酶、抗原和抗體在內的診斷試劑原料,其中診斷酶和抗原中一部分就是重組蛋白。
國內重組蛋白市場規(guī)模增長迅速。隨著生物藥的積極研發(fā)和對生命科學機理的深入探索,全 球重組蛋白生物科研試劑市場從 2015 年的 5 億美元增長到 2019 年的 8 億美元,預計 2024 年市 場規(guī)模將達到 15 億美元。中國重組蛋白生物科研試劑總體市場從 2015 年的 4 億元增長到 2019 年的 9 億元,預計 2024 年市場規(guī)模將達到 19 億元,9 年 CAGR 近 20%,行業(yè)規(guī)模增長迅速。
重組蛋白國產(chǎn)替代具備可行性。從研發(fā)實力、品牌影響力等方面來看,國內試劑生產(chǎn)企業(yè)和 國際知名企業(yè)相比仍然具有較大差距,我國重組蛋白科研試劑市場仍然主要由國外品牌占據(jù)。2019 年,中國重組蛋白試劑市場第一和第二名分別為 R&D Systems 和 PeproTech,合計占有 36%的 市場份額,國內前兩大企業(yè)義翹科技和百普賽斯僅占據(jù)不足 10%。其次市場競爭格局仍較為分散, 55%的市場份額由各個小體量公司所割據(jù)。但目前國內第一梯隊企業(yè)的產(chǎn)品質量已與國際一流產(chǎn) 品齊肩,未來國內企業(yè)有望憑借日益豐富的 SKU 和品牌口碑逐步形成規(guī)模效應,加速國產(chǎn)替代。
4.2.2 高端儀器設備是”生命科學產(chǎn)業(yè)鏈”國產(chǎn)化的首要陣地
科研儀器千億黃金賽道亟待國內企業(yè)開拓。據(jù) EMR 統(tǒng)計,2025 年全球高端科研儀器市場 規(guī)模有望達 3000 億元,復合增速約 9.6%。分析儀器是科研儀器的重要組成,占比約 45%,其 中質譜是分析儀器中最主要的儀器類型,據(jù)中國科技部統(tǒng)計,國內科研機構所屬的儀器中質譜儀 器貨值占比最高約 20%。
質譜法作為一種強大的方法和分析工具不斷發(fā)展,用于詳細分析粒子和分子。該技術的應用 涵蓋生命科學的所有領域,包括基礎發(fā)現(xiàn)研究項目、食品和環(huán)境測試、臨床應用、材料科學以及 藥物和生物治療開發(fā)。2018 年全球質譜儀在生物醫(yī)藥及科研領域占比達 65%。
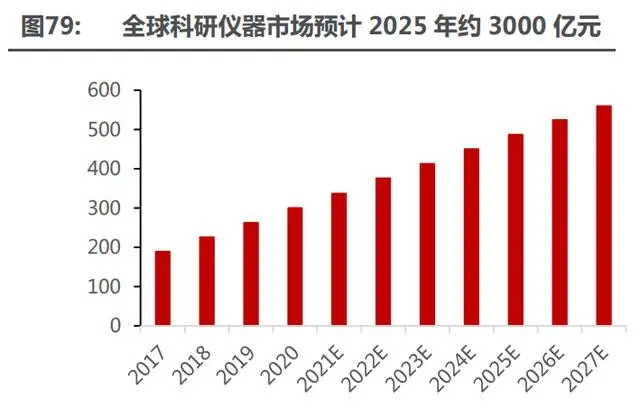
近年來我國質譜儀市場規(guī)模不斷擴大,據(jù)統(tǒng)計,截至 2020 年我國質譜儀市場規(guī)模達到 142.2 億元,2010-2020 年復合增長率為 17.77%。從地域來分北美 、 歐洲和中國是質譜儀主要分布 地,主要和區(qū)域內科研和制藥活動密切相關。目前國內質譜儀市場仍然依賴進口,近三年質譜進 口金額達 67 億美元,國產(chǎn)化率約 5%。
4.2.3 生命科學高分子耗材:全球視野下的朝陽行業(yè),孕育世界級企業(yè)的搖籃
耗材在”生命科學產(chǎn)業(yè)鏈”中扮演不可或缺的角色。生命科學高分子耗材在各類醫(yī)療和實驗 操作的應用場景中廣泛使用,涉略產(chǎn)品種類較多,包括細胞培養(yǎng)耗材、分子生物學耗材、 過濾/ 凈化實驗耗材、微生物學實驗耗材、儀器設備專用耗材、試劑類耗材等范疇,對應到產(chǎn)業(yè)端包括 基因測序、輔助生殖、實驗室耗材、體外診斷耗材、標本采集處理等。
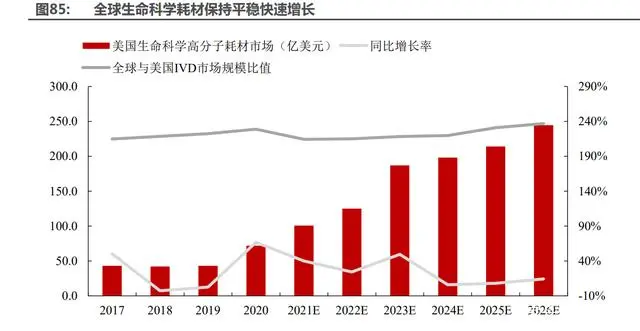
縱觀全球,生物醫(yī)療各領域快速發(fā)展帶動生命科學高分子耗材需求高速穩(wěn)定增長,預計 2025 年全球生命科學高分子耗材市場規(guī)模約 450 億美元,CAGR 約 13.8%。由于行業(yè)壁壘高,我國 在高端生命科學高分子耗材領域國產(chǎn)化率目前不足 5%。應用端主要賽道包括 IVD 儀器定制化耗 材、生命科學實驗耗材、輔助生殖耗材、基因測序耗材、標本采集處理等。其中 IVD 賽道集中 最高,CR4 達到 50%,所以耗材需求最為集中,有利于供應商快速放量,且亞太地區(qū) IVD 市場 空間較大,預計未來 5 年復合增速超過 15%,耗材市場增量空間可期。
優(yōu)質賽道享受高附加值和政策免疫擁抱高收益。醫(yī)療診斷和科研領域對于耗材質量的重視程 度遠高于采購成本,由耗材質量引起的診斷結果偏差、高值樣本試劑損失、實驗誤差等負面結果是本質性的差別。由于國內耗材供應商良莠不齊,國產(chǎn)耗材的市占率一直較低,也少有供應商能 進入國際巨頭的供應鏈。因此高分子生命科學耗材行業(yè)具備毛利高、國產(chǎn)及全球占有率極低的屬 性,當前在生命科學高分子耗材供應上具備先發(fā)優(yōu)勢的供應商將充分享受高分子耗材產(chǎn)能向國內 轉移的趨勢紅利,迅速打開國內和全球的生命科學耗材藍海市場。生命科學高分子耗材 ODM 模 式類似于藥品的 CDMO 產(chǎn)業(yè),并且耗材行業(yè)全球化屬性深種,國際化供應鏈市場為主。耗材供應 商直面下游各醫(yī)療實驗領域品牌商,耗材價值在下游產(chǎn)品占比較低,耗材價格更多取決于供需關 系。因此,生命科學耗材行業(yè)具備政策免疫屬性。
疫情打開本土企業(yè)切入塑膠耗材國際供應鏈的黃金窗口期。自 2020 年,全球進入疫情時代, 各產(chǎn)業(yè)普遍受到疫情影響。美國 USITC 透露,新冠檢測相關高分子生命科學耗材產(chǎn)能嚴重不足, 且產(chǎn)能無法立即提升。供需矛盾最突出的是移液吸頭,模具需要國外進口,耗時在 20 周左右,自 動化生產(chǎn)設備同樣需要額外調配,新產(chǎn)線的搭建周期在 8-14 個月。這將導致美國面臨長時間的移 液吸頭短缺,全球范圍可能面臨同樣的短期問題。截至 2021 年 3 月,美國進口的塑膠生命科學耗 材持續(xù)升高,其中中國份額大幅提升后維穩(wěn),與棉簽、試劑等數(shù)據(jù)先上升后回落的趨勢形成鮮明 對比。
4.2.4 “創(chuàng)新藥”大時代下,制藥設備行業(yè)呈現(xiàn)高景氣
近年來,國家出臺《“十四五”生物產(chǎn)業(yè)發(fā)展規(guī)劃內容》、《中國制造 2025》等政策,我國 生物”制藥裝備”產(chǎn)業(yè)處于重要發(fā)展階段。在帶量采購常態(tài)化、一致性評價、鼓勵新藥研發(fā)等背 景下,創(chuàng)新成為制藥產(chǎn)業(yè)發(fā)展的主旋律,制藥企業(yè)面臨工藝升級、設備更新的挑戰(zhàn),這將倒逼” 制藥裝備”產(chǎn)業(yè)繼續(xù)加快創(chuàng)新升級,技術從仿制創(chuàng)新朝著自主創(chuàng)新研發(fā)方向轉變,越來越多的自 主研發(fā)產(chǎn)品正在逐步替代進口,進行國際化發(fā)展,同時也發(fā)揮自身優(yōu)勢,推向國際市場;向整體 解決方案供應商轉型。制藥設備貫穿生物制藥全鏈條,包括培養(yǎng)基、發(fā)酵罐、生物反應器、生物 分離純化及超濾系統(tǒng)、制劑設備、凍干設備等。
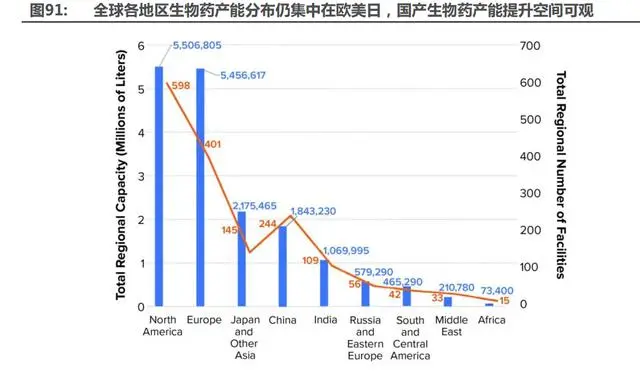
國內醫(yī)藥企業(yè)尤其生物醫(yī)藥企業(yè),所需的高端裝備,如疫苗類、蛋白類、細胞類等等,近百 億需求市場由國外企業(yè)占據(jù)。新冠疫情等事件的影響,為國內”制藥裝備”頭部企業(yè)開啟了替代 之門。生物制藥在國內快速發(fā)展。生物”制藥裝備”品質要求高,工藝關聯(lián)性強。生物醫(yī)藥企業(yè)為了快速申報和完成整個生產(chǎn)流程建設,廣泛采用生物反應器的一次性技術產(chǎn)品。現(xiàn)又面臨降成 本及供應鏈可靠保障的壓力,為國內”制藥裝備”企業(yè)提供機會。中國”制藥裝備”的頭部企業(yè), 最近幾年產(chǎn)品品質逐年提升,已達到或接近國外先進水平。
5、新消費:”醫(yī)療服務”長期邏輯不變,中藥消費品有望估值重塑
5.1 “醫(yī)療服務”:逐步淡化疫情影響,民營醫(yī)院長期發(fā)展空間廣闊
5.1.1 2021 年下半年”醫(yī)療服務”板塊受政策及疫情影響呈震蕩行情
回顧 2021 年,”醫(yī)療服務”板塊上半年由于去年疫情低基數(shù)疊加上半年消費需求旺盛的影 響推動”醫(yī)療服務”板塊走高,而下半年政策頻出增加了板塊不確定性,又疊加 2020 年下半年 高基數(shù)的影響下,板塊出現(xiàn)震蕩行情。
民營醫(yī)療定價靈活,將受益于醫(yī)療服務價格改革。深化醫(yī)療服務價格改革,預計整體調幅以 升為主。前期通過降低藥品耗材價格,為醫(yī)療服務價格改革創(chuàng)造了條件,為了規(guī)范管理醫(yī)療服務 價格,更適應臨床診療和價格管理需要,2021 年 8 月 31 日,國家醫(yī)保局等八部委聯(lián)合頒發(fā)《深 化醫(yī)療服務價格改革試點方案》旨在建立醫(yī)耗分開、醫(yī)療服務科學定價的價格體系。從近期部分 省份醫(yī)療服務價格調整情況上看,醫(yī)療服務中技術含量較高的項目價格得以提價。對于協(xié)議管理 的民營醫(yī)院來說,改革前醫(yī)療服務價格受到公立醫(yī)院價格以及醫(yī)保結算體制的影響,民營醫(yī)院收 費不具備優(yōu)勢,改革后公立醫(yī)院調高醫(yī)療服務價格,民營醫(yī)院會相應的更進調整,而有技術優(yōu)勢 的民營醫(yī)院會更明顯獲益。對于非納入?yún)f(xié)議管理的民營醫(yī)院來說,1)對于公立醫(yī)院開展的特需 及自費項目,公立醫(yī)院存在 10%的上限,而民營醫(yī)院可以以此通過服務與特色取得競爭優(yōu)勢;2) 對于公立醫(yī)院不開展的特需和自費項目,在政府價格規(guī)范下,民營醫(yī)院具有自主定價優(yōu)勢。
政策利空出盡,民營”醫(yī)療服務”邊際轉暖
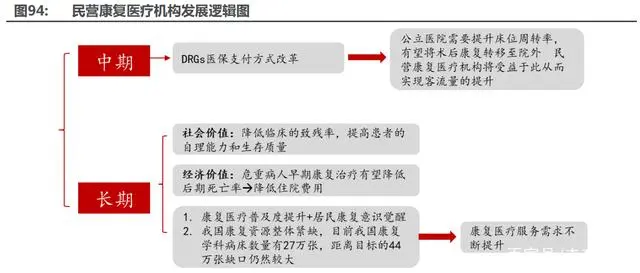
長期來看,醫(yī)療服務需求擴大,需求呈現(xiàn)多元化發(fā)展,公共醫(yī)療衛(wèi)生費用持續(xù)提升,引入社 會辦醫(yī)有利于:1)擴大服務供給;2)提供差異化服務緩解非基本醫(yī)療需求對公立醫(yī)院資源的 擠壓;3)建立競爭機制為”醫(yī)療服務”行業(yè)增值增效。中期上,口腔、眼科板塊政策利空出盡, 迎來邊際轉暖;醫(yī)美板塊受政策影響逐步消除;此外,我們預計在 DRGs 支付下,公立醫(yī)院為了 加快病床周轉率提高盈利水平,有望將康復業(yè)務轉移至院外,民營康復機構有望因此受益。短期 內,我們預計伴隨疫情的常態(tài)化,民營醫(yī)院受疫情影響基本消除,客流量逐步回暖。
5.1.2 康復及高端、特需民營醫(yī)療有望受益 DRGs 改革帶來的公立醫(yī)院資源轉移
DRGs/DIP 醫(yī)保支付方式改革促進民營醫(yī)院龍頭集中,此外作為公立醫(yī)院補充的康復以及高端、特需民營醫(yī)療機構也將獲得更好的發(fā)展機遇。DRGs/DIP 醫(yī)保支付方式改革倒逼公立醫(yī)院 管理更加精細化,促進醫(yī)療服務增質增量。民營醫(yī)院需要不斷提升自己精細化管理能力,控費增 質才能跟上公立醫(yī)院的腳步,龍頭民營機構優(yōu)勢凸顯。此外,在 DRGs 支付方式下,公立醫(yī)院有 意愿加快床位周轉以提高管理運營效率、控制費用,因此民營康復醫(yī)院作為公立醫(yī)療機構的有效 補充有望收益。與此同時,受到 DRGs 支付方式以及自費比的限制,公立醫(yī)院開展自費項目總量 受限,以此為高端、特需民營”醫(yī)療服務”市場發(fā)展創(chuàng)建空間。
長期來看,康復醫(yī)療一方面可以降低臨床的致殘率,提高患者的自理能力和生存質量;另一 方面,危重病人早期康復治療有望避免后期并發(fā)反應降低死亡率,由此可以降低住院費用。隨著 康復醫(yī)療普及度的提升和居民康復意識的覺醒,我國康復”醫(yī)療服務”需求不斷提升,2011 年 到 2019 年,康復醫(yī)學科門急診和出院人數(shù)快速增長,其中出院人數(shù)的 CAGR 約為 20%。但我 國康復資源整體緊缺,目前我國康復學科病床數(shù)量有 27 萬張,距離目標的 44 萬張缺口仍然較 大。中期上,在 DRGs 醫(yī)保支付方式改革下,公立醫(yī)院在提升床位周轉率的壓力下,有望將術后 康復轉移至院外進行,我們認為民營康復醫(yī)療機構將受益于此從而實現(xiàn)客流量的提升。
5.1.3 疫情影響與政策風險逐步淡化,需求助力專科醫(yī)療“長坡厚雪”
我國屬于“眼病大國”,眼科疾病患病人數(shù)基數(shù)大,其中近視眼約 7 億人,白內障 1.8 億人, 干眼癥約 2.4 億人,而隨著老齡化的加重,相關人群基數(shù)會進一步擴大。眼健康是國民健康的重 要組成部分,視覺損傷嚴重影響人民群眾的身體健康和生活質量,加重家庭和社會負擔,而根據(jù) WHO 統(tǒng)計的致盲因素中,白內障占 39%、屈光不正占 18%、青光眼占 10%,因此將眼科”醫(yī) 療服務”需求推入了剛需的范疇內,同時也拉動了眼科”醫(yī)療服務”市場的發(fā)展。
2018 年我國 眼科”醫(yī)療服務”市場規(guī)模擴大至 1083 億元,同比增加 14.9%,2013 年至 2018 年的 CAGR 為 14.72%。然而我國眼科疾病的診斷率遠低于美國且一些主要眼科治療項目的滲透率處于較低 的水平,橫向對比海外后續(xù)有較大的提升空間。中期來看,2020 年民營眼科”醫(yī)療服務”板塊 受角膜塑形鏡集采擔憂及 DRGs 支付方式改革的影響呈震蕩走勢。考慮到角膜塑形鏡目前滲透率 較低,且角膜塑形鏡屬于年度消費品,如被納入醫(yī)保,將對醫(yī)保造成很大負擔,因此我們預計角 膜塑形鏡被納入集采概率較低。此外,對于 DRGs 支付方式改革,我們認為民營醫(yī)院,例如愛爾 眼科,高端人工晶體手術占白內障整體手術比例較高,DRGs 對其白內障手術業(yè)務板塊影響有限。
5.2 政策促處方外流、龍頭集中,連鎖藥店揚帆再啟航
處方外流是國家提出的確定性大方向,藥占比、零加成、帶量采購等一系列政策促進處方外 流。中國 2017 年開始一步到位實施零加成,對應的醫(yī)藥分離率是 27.1%,而日本的醫(yī)藥分離率 在 70%,參考日本處方外流水平,我國處方外流可帶來千億市值增量。2018 年我國處方藥銷售 規(guī)模達到了 11266 億元,其中藥店處方藥銷售占總銷售額的 12.1%,銷售額達到 1363 億元。參考 2014 年日本藥店端處方藥銷售占銷售總額的 54.3%,如果中國處方藥外流達到日本水平, 藥店端處方藥銷售規(guī)模可達 6117 億元,有近 5 倍的提升空間,而龍頭藥店有望憑借自身規(guī)模化 經(jīng)營以及規(guī)范化管理優(yōu)勢實現(xiàn)強者恒強。
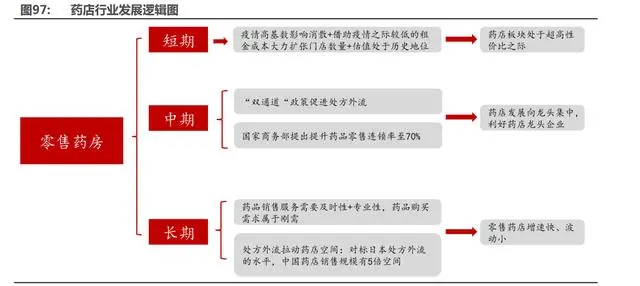
中期:近兩年國家出臺了一系列政策加速處方外流,促進行業(yè)集中度提升。2021 年 5 月 10 日,國家醫(yī)保局出臺了“雙通道”政策,通過定點醫(yī)療機構和定點”零售藥店”雙渠道,滿足藥 品供應及臨床使用,并同步納入醫(yī)保。雙通道模式一方面可以幫助藥店更好的承接處方的外流, 另一方面可以提高藥店客流量拉動其他藥品的銷售。在“雙通道”的模式下,藥店龍頭有望優(yōu)先 取得相關資質,進一步拉大大型藥房與中小型藥房的差距,從而實現(xiàn)行業(yè)向龍頭集中。此外國家 商務部于 2021 年 10 月 21 日提出將提升藥品零售行業(yè)連鎖率至 70%,促進行業(yè)規(guī)范、高質量 發(fā)展,行業(yè)整合加速,而藥店行業(yè)龍頭有望直接受益于此。
5.3 低估值中藥板塊有望迎來價值重塑的戰(zhàn)略機遇
5.3.1 中藥板塊處于低估值階段,有望迎來價值重塑
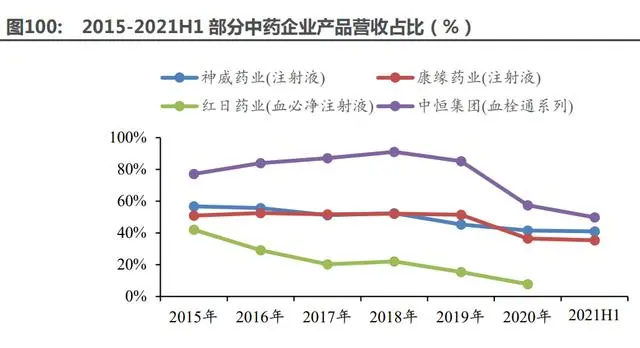
中藥是目前醫(yī)藥板塊中除醫(yī)藥流通之外估值最低的板塊。過去數(shù)年,中藥板塊在股票市場上 鮮有行情,僅2015年受益于大牛市和屠呦呦斬獲諾貝爾獎的事件利好,中藥板塊估值位于高點;在 2016 年以后,醫(yī)保目錄調整、限制中藥注射劑等事件的發(fā)生整體制約了行業(yè)發(fā)展,板塊估值 自 2015 年后一路下滑,至今仍在底部,估值低、安全性好。
中藥行業(yè)利空基本落地。目前我們認為過往數(shù)年積累的中藥行業(yè)利空基本落地,從中藥注射 劑銷售額來看,國內醫(yī)院端中藥注射劑銷售額降低至低位,中藥注射劑的受限已逐步消化。湖北 省集采落地,97 家企業(yè)的 111 種產(chǎn)品中選,中選率達 62%,平均降幅約 43%,中成藥集采降價 相對溫和。
中藥創(chuàng)新研發(fā)快速崛起:2021年中藥創(chuàng)新爆發(fā)注冊申報增長114.81%,11款中藥新藥獲批。2021 年國家藥品監(jiān)督管理局下發(fā)《中藥注冊分類及申報資料要求》,根據(jù)藥智數(shù)據(jù)統(tǒng)計,截至 2021 年 12 月 16 日,2021 年中藥新藥申報注冊受達 58 個(已受理號),比 2020 年增加 114.81%;申報臨床和申報上市分別有 48 個和 10 個,均創(chuàng)歷年新高。1 類創(chuàng)新藥占比總中藥新藥 86.21%, 包含 1.1 類新藥 36 個、1.2 類新藥 10 個以及 1.3 類 4 個。
5.3.2 國家政策支持中醫(yī)藥發(fā)展,行業(yè)規(guī)范化可期
國家級文件大力支持中醫(yī)藥,政策推進行業(yè)快速發(fā)展。2021 年國務院發(fā)布《關于印發(fā)深化醫(yī) 藥衛(wèi)生體制改革 2021 年重點工作任務的通知》,實施中醫(yī)藥振興發(fā)展重大工程,支持打造一批國 家中醫(yī)藥傳承創(chuàng)新中心、中西醫(yī)協(xié)同“旗艦”醫(yī)院等。“十四五”期間,浙江省規(guī)劃中醫(yī)藥重大 項目 115 個,涉及中醫(yī)”醫(yī)療服務”、中醫(yī)藥產(chǎn)業(yè)、科技創(chuàng)新等,中醫(yī)藥領域的投入資金將達到 560 億元。
5.3.3 中藥 OTC“高端消費”趨勢顯著
長期看好中藥消費品持續(xù)發(fā)力 OTC 市場,帶來業(yè)績+估值的雙升。自 2018 年以來醫(yī)保目錄 調整加速,集采措施在國家和地方層面頻繁進行,極大影響了藥品及器械行業(yè)的利潤空間,中藥 板塊性價比開始凸顯。長期來看,我們認為中藥板塊有眾多獨家品種,且百姓消費基礎好,在國 家政策支持+行業(yè)營銷改革改善+股權激勵保障等多輪利好沖擊下,有望看見部分中藥消費品持續(xù) 發(fā)力 OTC 市場,給企業(yè)帶來估值+業(yè)績雙升。
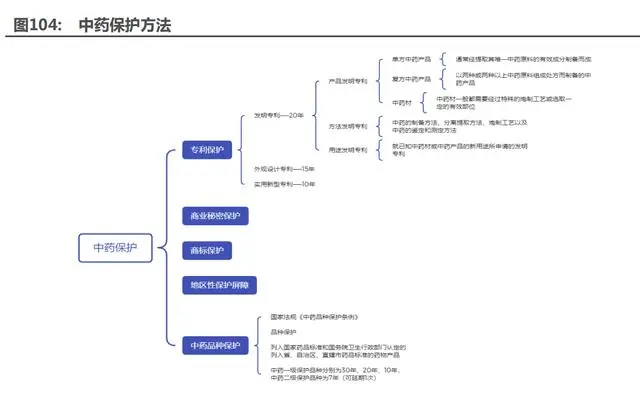
中藥 OTC“高端消費”趨勢——稀缺性。1)中醫(yī)藥板塊重視專利和配方保護,多個產(chǎn)品為獨 家品種或擁有獨家專利保護。中醫(yī)藥歷史悠久,品牌效應極強,獨家品種疊加優(yōu)勢品牌,使得優(yōu) 質中藥大單品供不應求,業(yè)績有望提升。
5.3.4 股權激勵+混改促進公司業(yè)績釋放
股權激勵充分保障公司業(yè)績釋放,行業(yè)向上空間打開。根據(jù)我們統(tǒng)計,2020 年開始多家中藥 上市公司出臺股權激勵和員工持股計劃,業(yè)績年增速要求集中在 10-20%,彰顯公司發(fā)展信心,行 業(yè)發(fā)展速度得到保障,向上空間充分打開。
5.4 血制品:“十四五”政策春風吹來,開啟成長新周期
5.4.1 國內血制品市場缺口大,多足鼎立格局已現(xiàn)
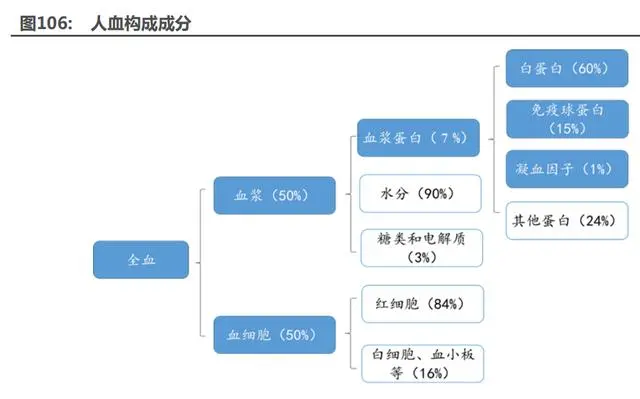
血制品源自健康人血漿。血制品是指由健康人血漿,經(jīng)蛋白提取、分離、純化、病毒滅活等 工序后制備出的用于臨床急救、診斷的產(chǎn)品總稱。血漿蛋白經(jīng)過分離純化可以得到白蛋白、免疫 球蛋白、凝血因子和其他蛋白,前三者即血制品。
中國血制品供不應求,行業(yè)景氣持續(xù)。2018-2020 年我國血液制品批簽發(fā)量整體明顯提升, 行業(yè)景氣度持續(xù)回升。2019 年我國血液制品相關產(chǎn)品總簽發(fā)量為 9240 萬瓶,同比上漲 24%;2020 年我國血液制品相關產(chǎn)品總簽發(fā)量為 9514 萬瓶,同比上漲 3%,增速有所放緩。長期來看,中國 人口老齡化情況下,對血制品的需從人均使用量情況來看,我國居民人均血液制品用量遠低于國 際水平,人血白蛋白人均年消耗小于 0.1g,免疫球蛋白人均年消耗小于 0.01g,凝血因子產(chǎn)品人 均年消耗小于 0.1IU,我們預計國內人均血制品使用量未來還有較大提升空間,血制品市場短期內 仍供不應求,行業(yè)景氣度將持續(xù)。
血制品企業(yè)少——行業(yè)法規(guī)監(jiān)管嚴格,準入壁壘高,形成存量競爭格局。血液制品具有人 源性、稀缺性和潛在傳染性,可視為一種國家戰(zhàn)略性資源,受到國家重點監(jiān)管,具有較高的準入 壁壘。具體體現(xiàn)在:1)近年來我國藥品生產(chǎn)企業(yè)監(jiān)管法律法規(guī)升級,血液制品行業(yè)的監(jiān)管法規(guī) 不斷完善,如《血液制品管理條例》等,法規(guī)中對原料血漿的采集、檢測、使用等各環(huán)節(jié)均有明 確的規(guī)定。2)血制品進口品類僅有人血白蛋白和凝血因子 VⅢ(2008 年批準)批準進口產(chǎn)品在 取得相應資質后進入中國市場,其余品類血制品產(chǎn)品則全部是國產(chǎn)產(chǎn)品。3)血制品直接源于人 體,為了防治艾滋病、肝炎等重大、慢性、血源性傳染病的爆發(fā),對國內不再批準新的血制品生 產(chǎn)企業(yè),這意味著國內血制品生產(chǎn)企業(yè)數(shù)量不再增加,國內競爭為存量競爭。
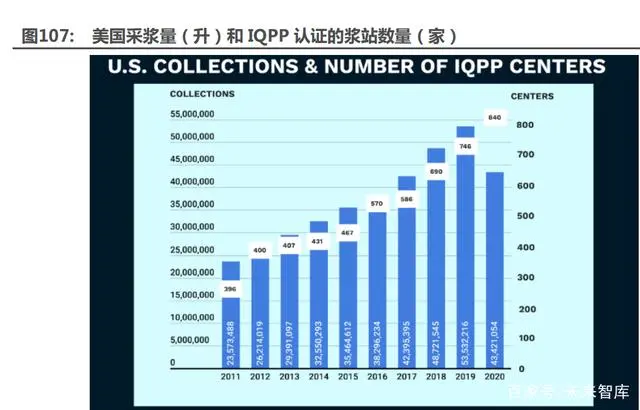
漿站數(shù)量少——采漿量不足已經(jīng)成為我國血液制品行業(yè)發(fā)展的瓶頸。血漿作為血制品的重要 原料,決定了血制品產(chǎn)量和市占率。衛(wèi)光生物 2020 年報披露,2019 年全球年采漿量超過 50000 噸,其中美國企業(yè)采漿量占比約 80%。美國的原料血漿 80%~90%來自于單采血漿站,10%~20% 來自于無償獻血機構。PPTA 數(shù)據(jù)顯示,2019 年美國采漿量 5353 萬升,通過 IQPP 認證的漿站 數(shù)量約 800 家。我國的血液制品生產(chǎn)企業(yè)的血漿來源全部由單采血漿站提供,國內單采血漿站統(tǒng) 一規(guī)劃、設置,采漿量與漿站數(shù)量、單個漿站采漿量直接掛鉤,進而直接影響終端產(chǎn)品供應。云 南省衛(wèi)健委顯示,2019 年底全國單采血漿站總數(shù) 269 家,覆蓋全國 700 余個縣,在冊獻漿者約 400 萬人,年采漿量 9201 噸,以此估算每個漿站采漿量為 34 噸。漿站數(shù)量少、采漿量不足已經(jīng) 成為制約我國血制品行業(yè)發(fā)展的關鍵限制因素。
血制品行業(yè)龍頭效應顯著,國內多足鼎立格局明顯。海外血制品市場發(fā)展歷程來看,海外(不 含中國)血制品企業(yè)數(shù)量從 20 世紀末超 100 家至目前僅剩不到 20家,市場集中度高,海外巨頭 如 CSL、Bayer Biologicals、Baxter、Grifols、Octapharma等占據(jù)血液制品市場份額約 80%, 其年采、投漿量超過 2000 噸,具備采漿量和血漿利用率優(yōu)勢。我國從 2001 年起不再批準新的血 制品生產(chǎn)企業(yè),目前我國血制品企業(yè)僅有約 28 家,國內血制品行業(yè)集中度相對偏低,產(chǎn)品種類少, 年投漿量遠遠低于歐美發(fā)達國家,呈現(xiàn)第一梯隊千噸級血制品公司、第二梯隊快速追趕的競爭格 局。
2020 年受新冠疫情影響,我國血制品企業(yè)采漿量共 8300 噸,僅天壇生物、華蘭生物、上海 萊士等頭部企業(yè)采漿量超過 1000 噸,旗下漿站數(shù)量居于市場前列,如天壇生物旗下 55 家漿站, 上海萊士 41 家,華蘭生物 25 家。大型血制品企業(yè)在盈利能力、經(jīng)營水平、研發(fā)能力均將與中小 規(guī)模企業(yè)迅速拉開差距,同時可通過優(yōu)質資產(chǎn)重組進一步提升行業(yè)集中度,步入強者恒強的寡頭競爭格局。
“十四五”期間新建漿站數(shù)量逐步提升,采漿量有望大幅提高,利好頭部企業(yè)。“十三五” 期間,國家加強采供血機構管理,持續(xù)推進采供血機構標準化和規(guī)范化建設,各省份新增漿站數(shù) 量有限。“十四五”期間,國家對新建漿站有望逐漸放開,云南省衛(wèi)健委已公布《云南省單采血 漿站設置規(guī)劃(2021—2023)》,全省共設置單采血漿站 19 個,多個血制品企業(yè)已與地方政府 進行洽談,國內血制品行業(yè)采漿量有望提速。同時,廣東省政策特別指出所屬單采血漿站在 3 年 內未能達到年采集量不少于 30 噸要求的血液制品生產(chǎn)單位,不得新增設置單采血漿站,這表明政 策仍向研發(fā)能力強、血漿綜合利用率高、單采血漿站管理規(guī)范的血液制品生產(chǎn)企業(yè)傾斜,利好血 制品龍頭企業(yè)。(報告來源:未來智庫)
5.4.2 血制品集采后預計價格體系仍能合理維持,中標有利于提升產(chǎn)品醫(yī)院滲透率
廣東牽頭血制品集采工作,預計價格體系仍能合理維持,同時提升國產(chǎn)血制品的醫(yī)院滲透率。2021 年 9 月 30 日,廣東藥品交易中心發(fā)布《廣東聯(lián)盟雙氯芬酸等 153 個藥品集團帶量采購文件 (征求意見稿)》,廣東省牽頭 10 省對 153 個品種進行集采,其中包括血制品,集采周期至 2023 年 12 月 31 日。
我們判斷:1)血制品仍然是供方市場:血制品依賴上游緊俏的原料血漿資源,公司 2020 年 報披露,我國實際血漿需求量保守預計超過 14000 噸,2020 年我國總體采漿量 8300 多噸,下游 市場需求仍旺盛,短期來看血制品市場處于供不應求狀態(tài),競爭格局好。
2)血制品降價幅度有限:血制品集采中標規(guī)則相對溫和,企業(yè)申報代表品規(guī)的報價小于等于 最高有效申報價和聯(lián)盟區(qū)最低價格兩者之間低值即可進入擬中選名單;若最高有效申報價是有一 定成交量的歷史實際交易價格,我們判斷血制品集采降價幅度有限。同時,本次集采對企業(yè)數(shù)量 沒有限制,中選即可獲得首年預采購量 100%。綜合考慮,我們預計血制品集采降價幅度較其他藥 物集采降價幅度小。
3)集采提高院內國產(chǎn)血制品滲透率,加強漿站規(guī)劃:集采政策下,血制品企業(yè)拓展醫(yī)院銷售 渠道,院內國產(chǎn)血制品比例增加,特別是人血白蛋白的國產(chǎn)替代有望加速。同時集采體量大,對 企業(yè)供應量要求高,企業(yè)需要加強漿站管理、拓展新漿站、穩(wěn)定采漿量;結合“十四五”相關政 策,預計國內單采血漿站設置將加速。
4)院外市場需求仍旺盛:血制品醫(yī)保覆蓋適應癥范圍相對有限,集采前大部分市場集中于院 外市場;集采后企業(yè)優(yōu)先供應院內市場,在總產(chǎn)量不變的情況下,院外市場供給相對減少。
5.4.3 血制品國際化提升行業(yè)發(fā)展上限
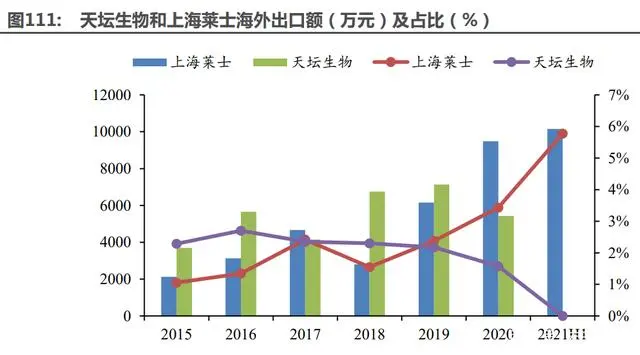
國內上市血制品企業(yè)中天壇生物、上海萊士血制品海外出口額較大,其中上海萊士出口額及 業(yè)績占比持續(xù)攀升。PTTA 數(shù)據(jù)顯示,2018 年中國采漿量總額占亞太地區(qū)的 75%,在亞太地區(qū)占 有較大優(yōu)勢,因此未來國內血制品可增加東南亞等地區(qū)的海外出口,提高業(yè)績天花板。
戰(zhàn)略層面上,國內血制品公司可以借鑒海外血液制品巨頭 CSL 的發(fā)展方向,對標國際一流水 平,優(yōu)化公司產(chǎn)品體系;營銷上積極拓展海外業(yè)務版圖,如借助國家“一帶一路”政策在海外國 家和地區(qū)實現(xiàn)產(chǎn)品注冊、漿站開發(fā)等,從而完成在產(chǎn)品研發(fā)和營銷方面與國際先進水平的雙重接 軌,提高公司業(yè)績上限。
相關新聞

美歐日醫(yī)療器械監(jiān)管法律制度概覽與思考
2000年,中華人民共和國國務院令第276號公布了《醫(yī)療器械監(jiān)督管理條例》(以下簡稱《條例》),構建了醫(yī)療器械法律制度的框架,我國醫(yī)療器械走上了依法治理的軌道。此后《條例》歷經(jīng)多次修訂和修改。2021年施行的新版《條例》貫徹“四個最嚴”要求,全面落實黨中央、國務院關于醫(yī)療器械審評審批制度改革精神,為鼓勵醫(yī)療器械產(chǎn)業(yè)創(chuàng)新高質量發(fā)展提供了堅實的法治保障。
9545個小時之前

最暢銷的基因與細胞療法TOP10盤點
2017年是細胞和基因治療領域具有里程碑意義的一年,在這一年里,美國食品和藥品監(jiān)督管理局(FDA)批準了首款CAR-T細胞療法(Kymriah)上市,還批準了首款AAV基因療法(Luxturna)上市。
9887個小時之前

檢查員說 | 淺談藥物警戒檢查后企業(yè)整改常見問題及解決辦法
自2021年12月1日《藥物警戒質量管理規(guī)范》(以下簡稱GVP)實施后,截至2023年底,筆者所在的北京市藥品不良反應監(jiān)測中心針對藥品上市許可持有人開展了107家次GVP符合性檢查。檢查員在督促企業(yè)整改過程中,常常發(fā)現(xiàn)企業(yè)不能一次性完成整改,一些問題不能及時糾正,大大降低了檢查整改工作效率。現(xiàn)對藥物警戒檢查后企業(yè)整改后出現(xiàn)的常見問題進行梳理并提出相關建議。
9887個小時之前

降脂“藥王”縮水76億,3款新藥大漲超100%!海正、魯南、京新獨家產(chǎn)品突圍
血脂調節(jié)劑是心腦血管系統(tǒng)藥物中重要的品類之一,也是首批被國采盯上的臨床常用藥物。經(jīng)歷了國采五年時間,該類藥物的市場規(guī)模大幅縮水,2020年至今在中國公立醫(yī)療機構終端已無百億品種,新上市產(chǎn)品則持續(xù)爆發(fā)活力。2023年信達生物的托萊西單抗注射液獲批,成為近年來首個上市的血脂調節(jié)劑生物藥1類新藥,打破了進口藥獨占市場的局面,君實、康方、恒瑞的PCSK9抑制劑正在沖刺上市,國內血脂調節(jié)劑市場又將迎來新局面。
10000個小時之前













