罕見病藥物迎來發展期
發布日期:2021-12-06 閱讀次數:11295 來源:中國食品藥品網
摘要:
12月3日,國家醫保局、人社部聯合印發《國家基本醫療保險、工傷保險和生育保險藥品目錄(2021年)》,共包括七款罕見病藥物:人凝血因子IX、醋酸艾替班特注射液、諾西那生鈉注射液、氨吡啶緩釋片、阿加糖酶α注射用濃溶液、依洛尤單抗注射液、氯苯唑酸軟膠囊。調整后的醫保藥品目錄將于2022年1月1日起實施,此舉將大幅改善我國罕見病患者沉重的治療負擔、生活質量嚴重受損的困境,也將為更多罕見病患者帶來希望。
多種罕見病藥物納入醫保
以第一批罕見病目錄中的121個病種為基礎,截至2021年12月3日,我國已有100余次適應癥獲批(以治療藥物適應癥獲批數量為計入單位,若一種化學分子有多個不同適應癥獲批,則重復計入),涉及58種罕見病。此外,仍有20余種罕見病在“超適應癥”使用治療藥物。而在獲批了適應癥的藥物中,已有57種藥物(同上,以適應癥計)被納入國家醫保藥品目錄,共涉及32種罕見病。(數據來源:艾昆緯分析整理+作者整理)
表1 納入2021年版國家醫保目錄的罕見病藥物
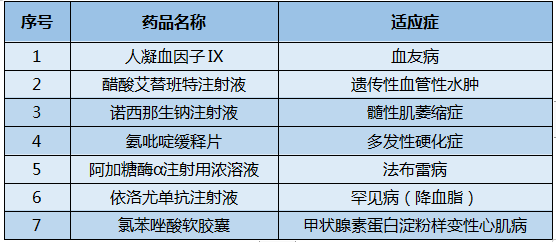
數據來源:國家醫保局網站
納入2021年版國家醫保藥品目錄的罕見病藥物中備受關注的是兩款渤健的高值產品:諾西那生鈉注射液和氨吡啶緩釋片,前者既是全球首個脊髓性肌萎縮(SMA)治療藥物,也是2016年首次“國談”起首次被納入醫保目錄的高值罕見病藥物。據央視新聞披露的一段談判現場視頻,諾西那生鈉注射液談判經歷了長達一個半小時,共2輪9次談判,最終從70萬元一針降到3萬多元一針。氨吡啶緩釋片作為全球首個且目前唯一一個用于改善多發性硬化(MS)患者步行功能障礙的藥物,在遞交上市許可申請當年即獲批,獲批當年即被納入國家醫保藥品目錄。武田也有兩款罕見病領域的創新藥物——醋酸艾替班特注射液和阿加糖酶α注射用濃溶液被納入2021年國家醫保藥品目錄,均是在進入中國市場短短一年就被迅速納入醫保。
2018年,國家醫保藥品目錄首次大面積納入罕見病藥物;2020年版醫保目錄中也納入了7個罕見病藥物。
表2 納入2020年版國家醫保藥品目錄的罕見病藥物
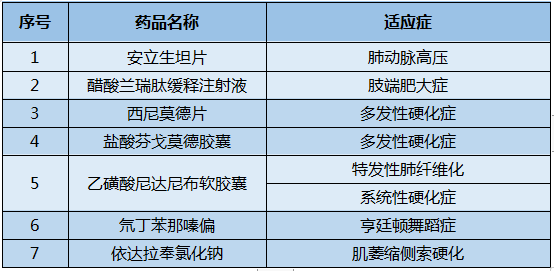
數據來源:國家醫保局網站
如上表,2020年通過準入談判將治療多發性硬化癥的西尼莫德、治療亨廷頓病的氘丁苯那嗪和治療肌萎縮側索硬化(ALS)的依達拉奉氯化鈉等多個罕見病藥品納入了2020年版國家醫保藥品目錄。這些藥品調入醫保后,大大提高了相應罕見病患者用藥的可及性。《中國醫保藥品管理改革進展與成效藍皮書》顯示,從罕見病用藥被納入醫保后的金額用量變化情況看, 2017年版調入藥品在目錄實施后一年內金額增長率在100%以上,金額及用量保持穩定增長趨勢;2019年版調入藥品近年來臨床用量較小,金額用量增幅明顯,在2020年第一季度新冠肺炎疫情影響下仍能保持高速增長趨勢。
國家政策加速罕見病藥物發展
近年來,國家出臺了一系列政策措施,促進罕見病藥物研發,提高罕見病藥物的可及性,如加速罕見病藥品審評審批,公布國家罕見病名錄,在醫保目錄調整中優先考慮罕見病等。罕見病藥物保障政策利好涉及藥物從研發注冊到上市使用的各個階段。
2018年10月,國家藥監局、國家衛健委聯合發布《關于臨床急需境外新藥審評審批相關事宜的公告》,對罕見病治療藥品等臨床急需境外新藥建立專門通道進行審評審批,明確要求對罕見病治療藥品在受理后3個月內完成技術審評。2019年新修訂《藥品管理法》明確規定對罕見病等疾病的新藥、兒童用藥開設綠色通道,優先審評審批。2020年新修訂《藥品注冊管理辦法》明確指出,臨床急需的境外已上市境內未上市的罕見病藥品,審評時限為七十日。2021年10月,國家藥監局藥審中心就《罕見疾病藥物臨床研發技術指導原則(征求意見稿)》公開征求意見,旨在進一步提高罕見疾病臨床研發效率,滿足罕見疾病患者的治療需求,結合罕見疾病特征,對罕見疾病藥物研發及科學的試驗設計提供建議和參考。
受到罕見病藥物保障利好政策的影響,國內各大藥企開始布局罕見病領域。據艾昆緯數據,截至2021年10月21日,21種罕見病藥品通過優先審評審批獲批上市,覆蓋罕見病病種包括黏多糖貯積癥、亨廷頓舞蹈癥、多發性硬化、脊髓性肌萎縮癥等15種罕見病,幫助眾多罕見病患者解決了治療藥物非常有限,甚至無藥可用的困境。
在2021年版醫保藥品目錄公布的前一天,又有一款罕見病藥物在我國獲批上市。國家藥監局通過優先審評審批程序批準了臨床急需罕見病藥品注射用司妥昔單抗(英文名: Siltuximab for Injection)的進口注冊申請,用于人體免疫缺陷病毒(HIV)陰性和人皰疹病毒8型(HHV-8)陰性的多中心Castleman病(MCD)成人患者。司妥昔單抗于2014年首次在國外上市。在中國,該藥曾因罕見病用藥被納入《第一批臨床急需境外新藥》名單。百濟神州從EUSA Pharma引進的另一款靶向GD2的單克隆抗體達妥昔單抗β(dinutuximab beta)也于今年8月在中國獲批上市。達妥昔單抗β也是一款用于罕見病的藥物,在中國獲批用于治療12月齡及以上的高危神經母細胞瘤患者。這是一種兒童常見的顱外腫瘤,在兒童腫瘤中占比約為6%-10%。
不論是新的罕見病藥物獲批上市,還是鼓舞人心的罕見病藥物納入醫保,都在表明罕見病藥物進入了發展時期。“將更多救命救急的好藥納入醫保目錄”,是國家醫保局主導的醫藥改革主線。治療罕見病的“孤兒藥”、臨床缺乏的兒童用藥,已經是每年醫保藥品目錄調整的重點。在過去的11年間,我國醫保目錄涵蓋的罕見病用藥種類已經翻倍,讓越來越多的罕見病患者受益。可以預見,隨著未來更多的罕見病藥物上市并納入醫保,對于罕見病臨床治療和產業發展,具有非常重要的意義。
相關新聞

醫學科普,聽得懂更要講得對
新一輪科技革命推動醫學科技迅速發展,新裝備、新技術、新藥、新方案等已深度影響“促、防、診、控、治、康”各環節,這也為健康科普提供了高水平的傳播內容和傳播載體。醫學科普是以通俗易懂的方式將健康領域的科技知識、科學方法、科學思想和科學精神傳播給公眾,旨在培養公眾的健康素養,幫助公眾學會自我健康管理的長期性活動。建設健康中國,醫學科普工作具有重要意義和獨特作用。
9933個小時之前


基于質量源于設計路線的生物類似藥質量研究
24980個小時之前

淺談AI技術在COVID-19診療中的應用
25148個小時之前

“OK鏡”市場迎來變數?療效及安全備受關注
25148個小時之前













