醫保局公布重點監控目錄,一批大品種納入
發布日期:2022-02-11 閱讀次數:11404 來源:賽柏藍
摘要:
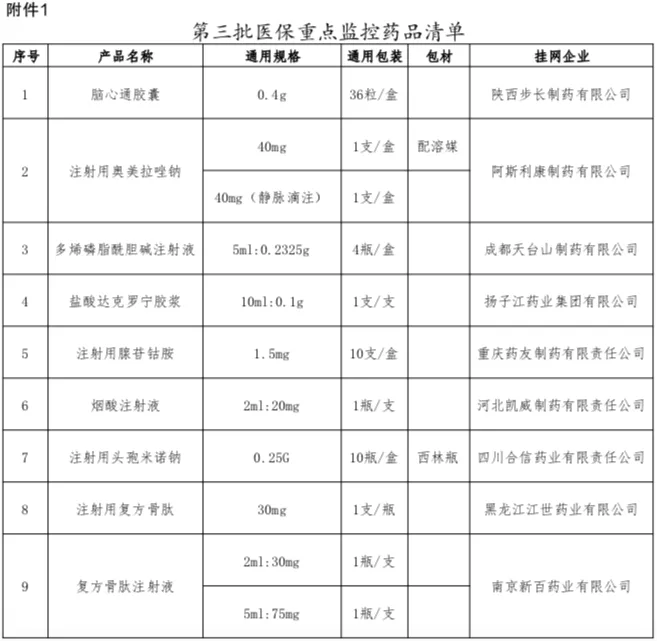
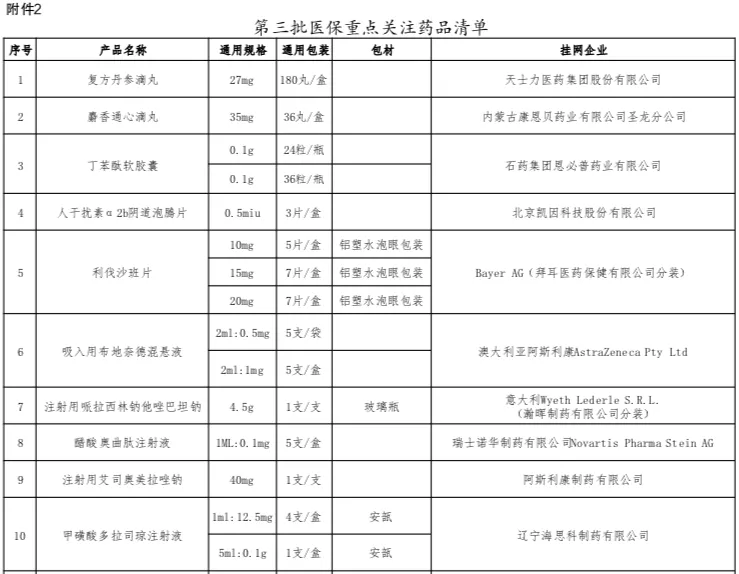
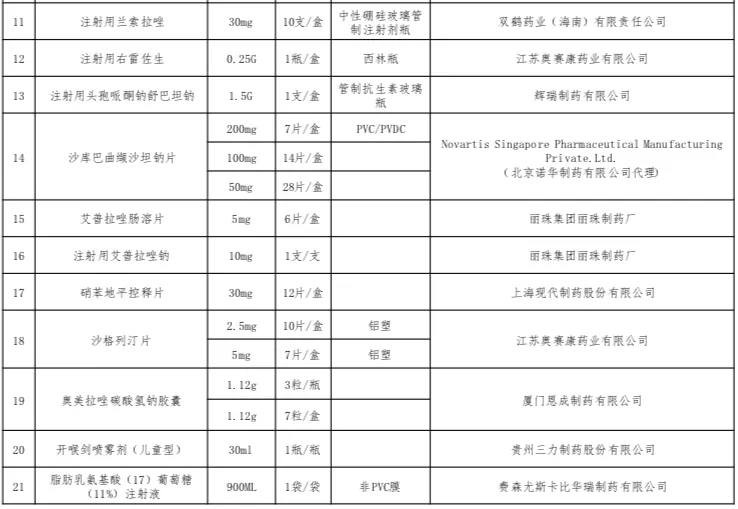
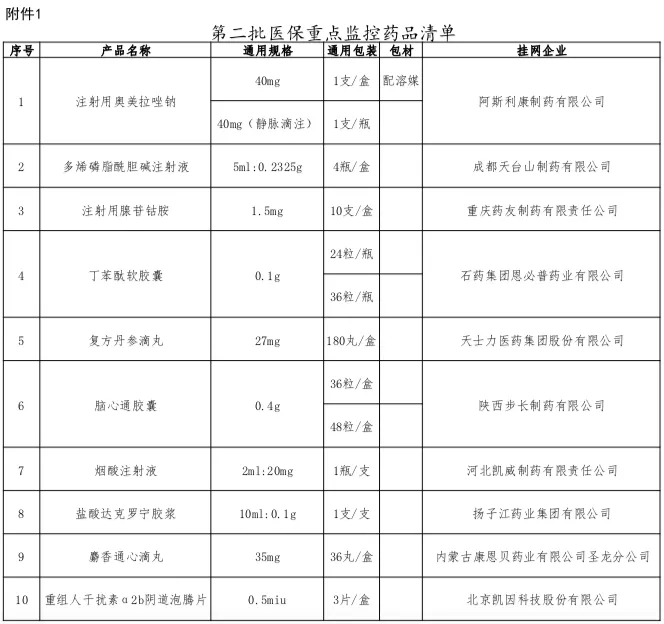
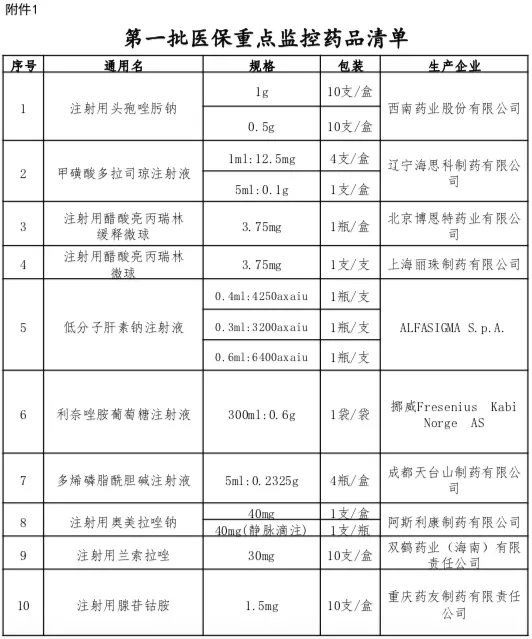
醫改明星省份福建再次發布醫保重點監控藥品目錄,注射用奧美拉唑鈉、復方骨肽注射液等9個大品種在列。2月8日,福建省醫保局發布《關于公布第三批醫保重點監控藥品和重點關注藥品清單的通知》,要求相關單位加強重點監控、重點關注藥品管理。第三批醫保重點監控藥品清單共納入9個品種,醫保重點關注藥品清單則囊括了21個品種——與此前兩批重點監控、重點關注藥品清單相比,數量明顯縮減。據統計,第二批醫保重點監控藥品清單涉及丁苯酞軟膠囊、復方丹參滴丸等10個大品種,第二批醫保重點關注藥品納入品種的數量高達59個,包含康艾注射液、康萊特注射液、血必凈注射液等中藥注射劑和依達拉奉氯化鈉注射液、利伐沙班片、甲磺酸奧希替尼片等化藥大品種。第一批醫保重點監控藥品清單納入的品種也是10個,低分子肝素鈉注射液等在列,第一批醫保重點關注藥品清單覆蓋44個大品種,如門冬胰島素30注射液、注射用頭孢哌酮鈉舒巴坦鈉、注射用曲妥珠單抗、纈沙坦氨氯地平片 (I)、利伐沙班片等。今日,一位醫藥行業資深人士對賽柏藍表示,從第一批到第三批,福建醫保重點關注藥品清單的數量明顯減少與國家帶量采購的常態化開展有關——分析第一批醫保重點關注藥品清單的44個品種不難發現,多數都是跨國藥企的原研產品。根據2019年4月2日福建醫保局發布的《福建省醫療保障局關于加強醫保重點監控藥品管理的通知》(以下簡稱《通知》)——這是確立福建醫保重點監控制度的最重要文件,原則上國家帶量采購藥品在采購周期內不納入重點監控范圍。從2018年12月至今,國家集采針對化藥開展了五批,共218個品種中選,第七批國家組織藥品集采又納入奧美拉唑注射劑等58個化藥,第六批胰島素專項探索性集采16個胰島素品種。伴隨著國采將臨床常用的、占據醫保資金較多的、過一致性評價企業滿3家的品種納入集采,福建醫保重點關注藥品清單的不少原研品種已經被國采,如丙泊酚中/長鏈脂肪乳注射液、紫杉醇注射液、阿托伐他汀鈣片、利伐沙班片、纈沙坦氨氯地平片 (I)等。原研品種在福建省逐漸擺脫重點關注的原因包括:一、因符合國采要求被納入帶量采購;二隨著仿制藥替代效應的顯現,不少未中標原研品種在公立醫院的銷量已經跌落。確實,福建醫保局在昨日的通知中指出,原屬于第二批重點監控、重點關注清單中的藥品,除被列入第三批重點監控、重點關注清單藥品外,其他藥品不再執行重點監控和重點關注。福建省開展醫保重點監控藥品監管主要是為了控制醫療費用不合理增長,加強合理用藥。根據上述《通知》,符合下面6種情形的藥品納入重點監控評估范圍:1.月均發貨金額超過500萬元的藥品(按全省數據統計,下同);3.月均發貨金額超過200萬,且環比增長30%以上的藥品;4.非疾病治療必需、臨床療效證據不充分、未獲得權威疾病診療指南推薦或未納入臨床路徑表單、不具備藥物經濟學優勢的藥品;5.通過履約監測、醫保稽核監管、舉報投訴發現存在銷售、使用異常的藥品;具體到日常監測層面,福建省藥采中心和省醫保中心在對省級采購平臺上的交易數據、藥物作用機理與臨床應用、日常履約監測、醫保稽核監管、舉報投訴情況等進行綜合分析基礎上:重點對屬于抗菌藥物、中藥注射劑、輔助性藥品、營養性藥品、無特殊原因使用量快速增長的藥品以及其他價格高、用量大的藥品進行評估,提出擬納入重點監控藥品清單報省醫保局研究確定。福建對重點監控藥品清單實行動態管理,原則上每半年調整一次——據賽柏藍統計,福建第一批重點監控藥品清單發布于2020年7月31日,第二批發布于2021年3月30日,相隔的時間基本在半年以上。福建同步建立了重點監控藥品采購使用異常預警制度——按月對納入重點監控清單的藥品采購、使用金額、排名、增長情況等進行監測分析。針對納入重點監控清單的藥品,生產、配送企業需做出情況說明,使用占比較高的醫療機構會被進行使用異常預警通報。如果月發貨金額超過500萬元,生產企業從次月起需按規定調低掛網價,并相應調整最高銷售限價及醫保支付標準,調低的掛網價不再回調。如果針對重點監控藥品的采購使用異常整改不力或拒絕整改的,企業可能面臨暫停相關藥品貨款支付、暫停掛網、撤銷掛網等處理。具體到臨床使用端,福建還會按有關規定和醫療服務協議從嚴處理存在不合理用藥情形的醫師和醫療機構,如予以約談、通報、暫停醫保處方權等。一位不便具名的行業權威專家對賽柏藍表示,和國家衛健委發布的重點監控合理用藥藥品目錄不同的地方是:一、福建版醫保重點監控和國家重點監控藥品目錄完全獨立;二、標準簡單,銷售額是核心指標;三、無禁忌,中藥西藥均納入;四、目的主要是控費。賽柏藍特約撰稿專家易老師也指出,醫保局的重點監控以價格和控費為主,衛健委的重點是臨床使用、不良反應等。根據2021年9月3日,國家衛健委發布的《國家衛生健康委辦公廳關于印發國家重點監控合理用藥藥品目錄調整工作規程的通知》,納入目錄管理的藥品以“臨床使用不合理問題較多、使用金額異常偏高、對用藥合理性影響較大的化學藥品和生物制品為主,包含輔助用藥、抗腫瘤藥物、抗微生物藥物、質子泵抑制劑、糖皮質激素、腸外營養藥物等。此外,國家版重點監控藥品目錄調整周期也不一樣,原則上不短于3年,納入目錄管理的藥品品種一般為30個。一版國家重點監控合理用藥藥品目錄的出臺需要經過啟動調整、地方遴選推薦、專家匯總、公布結果4個階段。醫療機構在上報藥品時會考慮臨床不合理使用現狀、使用金額、臨床價值等綜合因素。最終,國家重點監控藥品目錄的限制主要來自于臨床端——對納入目錄中的全部藥品開展處方審核和處方點評,加強處方點評結果的公示、反饋及利用;對用藥不合理問題突出的品種,采取排名通報、限期整改、清除出本機構藥品供應目錄等措施,保證合理用藥。基于國家重點監控合理用藥藥品目錄,各級還會陸續發布省級、市級、醫院級的重點監控目錄。上述專家進一步指出,福建醫保重點監控因為標準簡單釋放給廠家和藥商的信息也很明確,醫藥企業在福建市場的壓力不小,不過這種重點監控的形式不太可能推廣到全國。就福建重點監控,今日一位藥企高管也對賽柏藍指出,從福建重點監控和重點關注的清單來看,重點監控清單上的品種也存在臨床過度使用的可能性,至于重點關注清單的不少原研產品,有臨床上的需求,但不是每位患者必須要用。重點監控高壓線之下,清單外企業還要做好風險防范工作,控制價格和用量(尤其是類似產品),以避免進入監控和關注清單。