中國(guó)罕見(jiàn)病藥物支持政策梳理(上):研發(fā)和注冊(cè)
發(fā)布日期:2021-11-26 閱讀次數(shù):12655 來(lái)源:中國(guó)食品藥品網(wǎng)
摘要:
近年來(lái),罕見(jiàn)病患者的用藥問(wèn)題,日益受到國(guó)家層面的高度重視。國(guó)家出臺(tái)了一系列政策,如加速罕見(jiàn)病藥品審評(píng)審批、公布國(guó)家罕見(jiàn)病名錄、在醫(yī)保目錄調(diào)整中優(yōu)先考慮罕見(jiàn)病等,以提高罕見(jiàn)病藥品的可及性。
回溯歷史,全國(guó)范圍內(nèi)對(duì)于罕見(jiàn)病的相關(guān)支持政策從無(wú)到有,罕見(jiàn)病藥物保障政策利好涉及藥物從研發(fā)注冊(cè)到上市使用的各個(gè)階段。
本系列將從罕見(jiàn)病藥物生命周期的角度梳理近年來(lái)中國(guó)罕見(jiàn)病藥物保障方面的相關(guān)政策,作為系列文章的上篇,本文將主要聚焦罕見(jiàn)病藥物研發(fā)和注冊(cè)相關(guān)政策。
罕見(jiàn)病定義的修訂及完善
在中國(guó),罕見(jiàn)病尚沒(méi)有明確的法律釋義。專家表示隨著醫(yī)學(xué)進(jìn)步和社會(huì)對(duì)罕見(jiàn)病認(rèn)知的不斷提高,罕見(jiàn)病定義要符合不斷變化和發(fā)展的歷史,應(yīng)當(dāng)對(duì)罕見(jiàn)病定義適時(shí)進(jìn)行調(diào)整,使其符合社會(huì)發(fā)展的特點(diǎn)和民眾的需求。
罕見(jiàn)病定義的修訂和完善,有利于中國(guó)罕見(jiàn)病診療與保障事業(yè)的規(guī)范化、制度化、法治化發(fā)展。罕見(jiàn)病定義將可能成為制定中國(guó)罕見(jiàn)病目錄的主要標(biāo)準(zhǔn)之一、制定中國(guó)孤兒藥定義的參考依據(jù)之一、調(diào)整國(guó)家基本藥品目錄的參考依據(jù)之一。
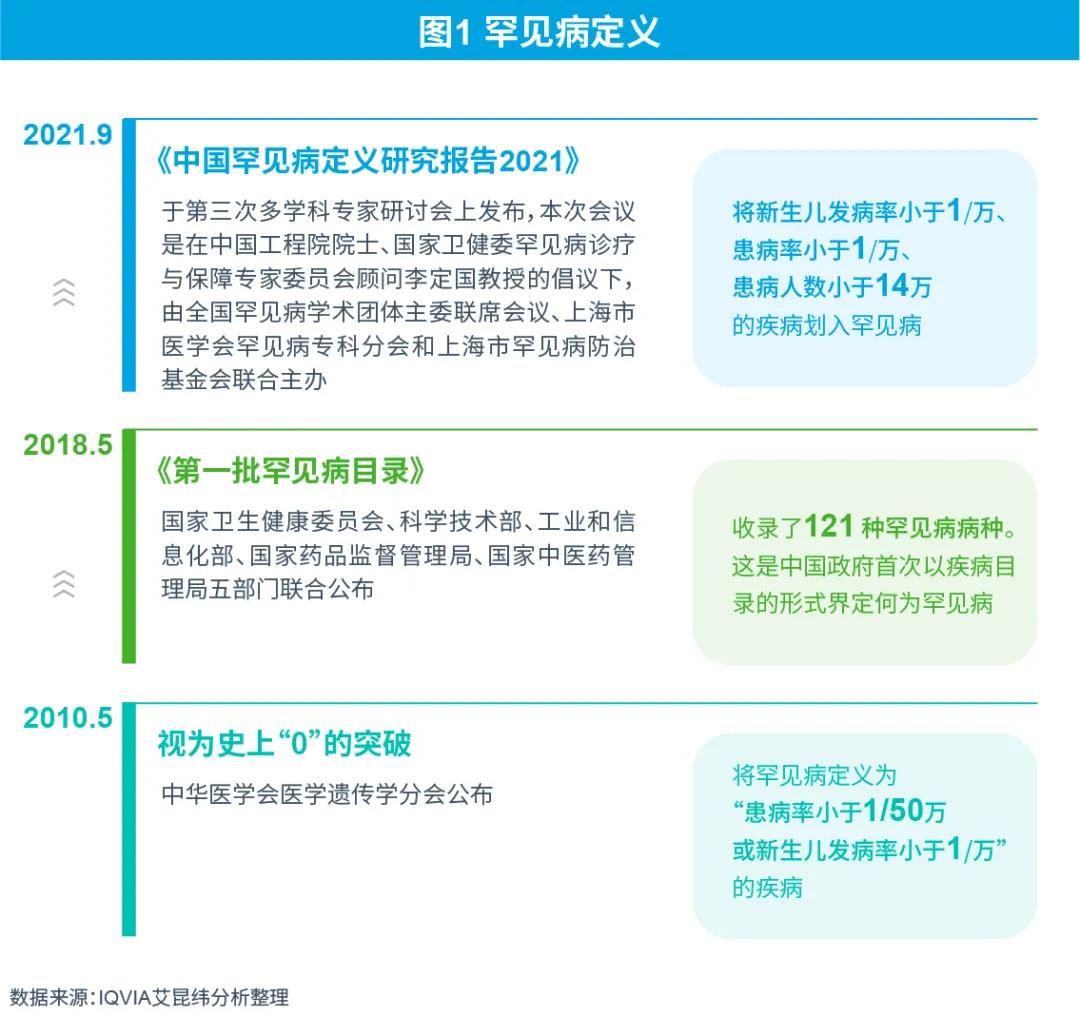
中國(guó)罕見(jiàn)病目錄公布及更新
2018年5月《第一批罕見(jiàn)病目錄》公布是中國(guó)罕見(jiàn)病管理的一個(gè)里程碑式事件,因?yàn)槭且阅夸浀男问酱_定了罕見(jiàn)病的定義,有了目錄以后,醫(yī)療藥品審批,包括保障都有了重要的參考依據(jù)。
2021年4月27日,全國(guó)罕見(jiàn)病診療協(xié)作網(wǎng)辦公室副主任、中國(guó)罕見(jiàn)病聯(lián)盟執(zhí)行理事長(zhǎng)李林康介紹了第二批罕見(jiàn)病目錄的制定進(jìn)展。李林康指出,2021年要適時(shí)地開(kāi)展第二批目錄的遴選工作,到目前為止,國(guó)家衛(wèi)健委罕見(jiàn)病診療與保障專家委員會(huì)辦公室已經(jīng)收到了將近200份申請(qǐng),將進(jìn)行材料審評(píng)、專家論證和公示等既定的遴選程序。

罕見(jiàn)病藥物研發(fā)相關(guān)政策
國(guó)家鼓勵(lì)創(chuàng)新,減少罕見(jiàn)病等創(chuàng)新藥物上市的滯后性,從而減少新藥在美國(guó)和中國(guó)之間的批準(zhǔn)時(shí)間差。

案例:2017年,全球首個(gè)治療龐貝氏病的罕見(jiàn)病藥物“美而贊”(注射用阿糖苷酶α),通過(guò)原國(guó)家食品藥品監(jiān)督管理總局免三期臨床試驗(yàn)的政策,獲準(zhǔn)進(jìn)入中國(guó)市場(chǎng)。
罕見(jiàn)病藥物注冊(cè)相關(guān)政策
政策的利好加速了審評(píng)審批速度,起到了罕見(jiàn)病藥品上市“加速器”的作用。

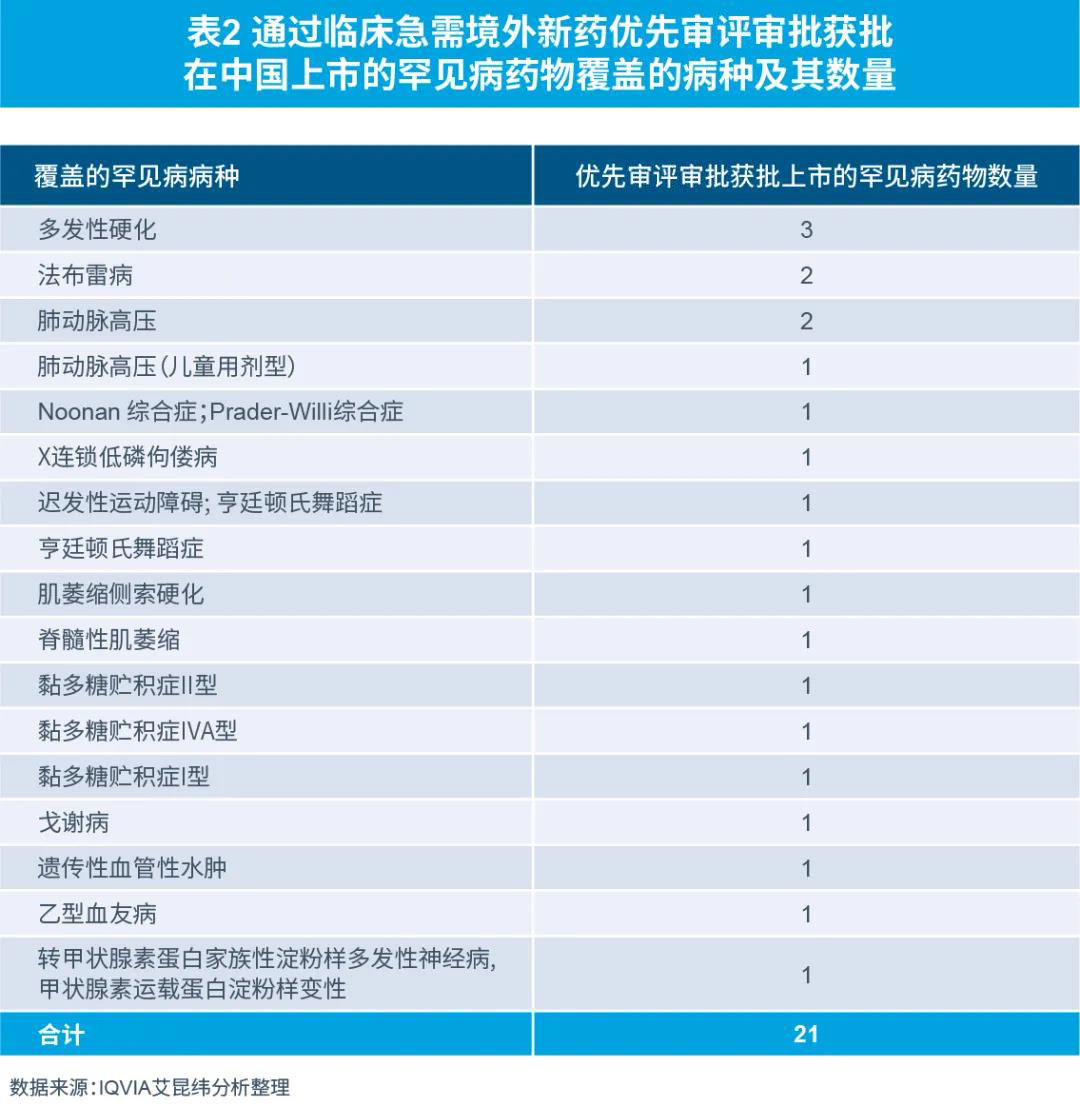
在罕見(jiàn)病藥物注冊(cè)審批方面,國(guó)家藥監(jiān)局從2018年11月開(kāi)始到2020年10月,三次共推出81種境外已上市臨床急需新藥名單,列入名單的品種可按《臨床急需境外新藥審評(píng)審批工作程序》提交相關(guān)資料,直接提出上市申請(qǐng),CDE建立專門(mén)通道加快審評(píng)。尚未申報(bào)的品種,可提出與國(guó)家藥監(jiān)局藥審中心(CDE)進(jìn)行溝通交流,盡快提出上市申請(qǐng)。

截至2021年10月21日,21種罕見(jiàn)病藥品通過(guò)優(yōu)先審評(píng)審批獲批上市,其中:
2021年獲批上市7種
2020年和2019年各獲批上市6種
2018年獲批上市1種
還有1種上市時(shí)間未知
通過(guò)臨床急需境外新藥優(yōu)先審評(píng)審批獲得中國(guó)上市的21種罕見(jiàn)病藥物覆蓋罕見(jiàn)病病種包括黏多糖貯積癥、亨廷頓舞蹈癥、多發(fā)性硬化、脊髓性肌萎縮癥等15種罕見(jiàn)病,幫助眾多罕見(jiàn)病患者解決了治療藥物非常有限,甚至無(wú)藥可用的困境。
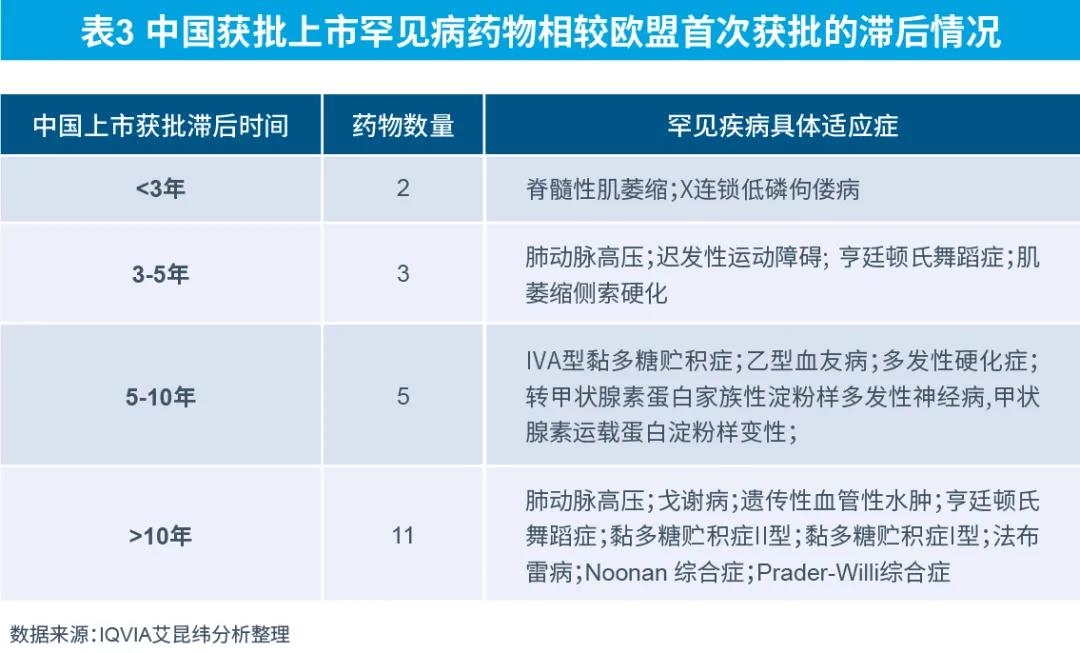
目前我國(guó)獲批上市罕見(jiàn)病藥物與歐盟首次獲批時(shí)間相比,即使是通過(guò)優(yōu)先審評(píng)審批,上市時(shí)間仍滯后平均約9.5年。
相關(guān)新聞

《藥品生產(chǎn)質(zhì)量管理規(guī)范(2010年修訂)》血液制品附錄(修訂稿)政策解讀
9359個(gè)小時(shí)之前

《血液制品生產(chǎn)智慧監(jiān)管三年行動(dòng)計(jì)劃(2024—2026年)》政策解讀
9359個(gè)小時(shí)之前

《血液制品生產(chǎn)檢驗(yàn)電子化記錄技術(shù)指南(試行)》政策解讀
9359個(gè)小時(shí)之前

《近視防治指南(2024年版)》專家解讀
9503個(gè)小時(shí)之前

我國(guó)兒童抗菌藥物使用管理相關(guān)策略及述評(píng)
9575個(gè)小時(shí)之前













