Molecular Cancer | 邁向癌癥治療新紀元:CAR-M療法的臨床潛力
發布日期:2024-06-03 閱讀次數:2756 來源:生物探索
摘要:近年來,嵌合抗原受體(CAR)技術在血液腫瘤治療中取得了顯著進展,特別是在急性淋巴細胞白血病(ALL)、淋巴瘤和漿細胞骨髓瘤(PCM)等方面。然而,CAR-T細胞療法在實體瘤治療中的效果仍不盡如人意。這促使研究人員開始探索替代性的免疫治療方法,以克服當前CAR-T細胞面臨的重大挑戰。具有強大吞噬能力、抗原呈遞功能以及能夠調節腫瘤微環境和刺激適應性反應的巨噬細胞成為一種有前景的選擇。
近年來,嵌合抗原受體(CAR)技術在血液腫瘤治療中取得了顯著進展,特別是在急性淋巴細胞白血病(ALL)、淋巴瘤和漿細胞骨髓瘤(PCM)等方面。然而,CAR-T細胞療法在實體瘤治療中的效果仍不盡如人意。這促使研究人員開始探索替代性的免疫治療方法,以克服當前CAR-T細胞面臨的重大挑戰。具有強大吞噬能力、抗原呈遞功能以及能夠調節腫瘤微環境和刺激適應性反應的巨噬細胞成為一種有前景的選擇。CAR-M療法(CAR-巨噬細胞療法)利用巨噬細胞的特性,通過基因工程手段賦予其特定的抗腫瘤能力。巨噬細胞在腫瘤中的主要作用包括吞噬癌細胞、分泌細胞因子和趨化因子、滲透致密組織并在腫瘤中積累等。這些特性使得巨噬細胞成為CAR免疫療法中可操作的候選者。自2006年Biglari等人首次將CEA靶向的CAR分子工程化到人類單核細胞中以來,CAR-巨噬細胞的開發和優化工作不斷進行。目前已有兩種CAR-M療法(CT-0508和MCY-M11)獲得美國食品藥品監督管理局(FDA)的批準進入臨床試驗階段。盡管取得了一定進展,CAR-M療法仍處于起步階段,面臨著細胞資源有限、基因轉移抗性和潛在的炎癥病理等重大問題。隨著人類誘導多能干細胞(iPSCs)制備、基因編輯技術和生物材料遞送技術的結合,新一代CAR-M療法有望具備特定的腫瘤抗原識別能力、可行的基因修飾、改進的擴展能力和可控的安全性。6月1日Molecular Cancer “A new era of cancer immunotherapy: combining revolutionary technologies for enhanced CAR-M therapy”回顧了CAR-M療法的最新進展,涵蓋了基礎科學研究和臨床試驗,并探討了當前阻礙CAR-M療法全面潛力實現的主要障礙及其解決策略。隨著基因編輯、合成生物學技術和生物材料支持的基因轉移等革命性技術的出現,結合這些先進方法將帶來新一代CAR-M療法,提高其療效、安全性和可及性。CAR-M療法不僅展示了對抗血液和非血液腫瘤的潛力,還預示著未來在癌癥免疫治療中的廣闊應用前景。
近年來,嵌合抗原受體(Chimeric Antigen Receptor, CAR)技術在癌癥治療領域取得了突破性進展,尤其是在血液腫瘤的治療中。然而,CAR-T細胞(CAR-T Cell)在治療實體腫瘤方面的效果仍然有限,這促使研究人員探索新的免疫治療方法。巨噬細胞(Macrophages)作為先天免疫系統的主要細胞,因其多功能性和在腫瘤微環境中的重要作用,成為了CAR療法的新興候選者。巨噬細胞是體內主要的吞噬細胞,能夠吞噬并消化細菌、病毒和癌細胞等病原體。巨噬細胞不僅具有強大的吞噬能力,還具有抗原呈遞(Antigen Presentation)功能,可以激活適應性免疫反應。此外,巨噬細胞在組織修復、炎癥反應和免疫調節中發揮著重要作用。基于這些特性,研究人員開始探索將CAR技術應用于巨噬細胞,以開發新的癌癥免疫治療方法。CAR是一種人工設計的跨膜受體,通常包括一個識別腫瘤抗原的單鏈可變區(Single-chain Variable Fragment, scFv)、一個鉸鏈區(Hinge Domain)、一個跨膜區(Transmembrane Domain)和一個胞內信號傳導區(Intracellular Signaling Domain)。通過基因工程手段將CAR導入巨噬細胞,使其能夠特異性識別并殺傷表達相應抗原的癌細胞。
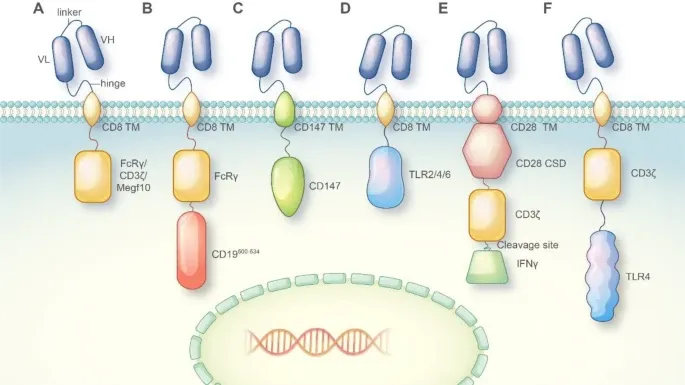
不同CAR的組成元素及其在CAR-巨噬細胞設計中的應用(Credit: Molecular Cancer)
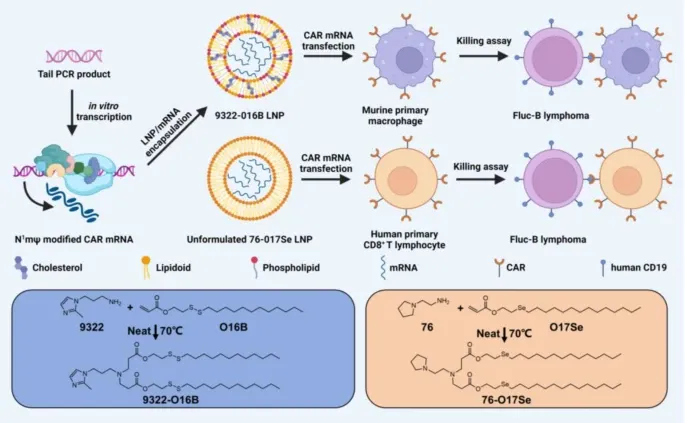
單鏈可變區(Single-chain Variable Fragment, scFv):scFv是位于CAR細胞表面的部分,通過連接序列與腫瘤抗原靶向抗體的重鏈可變區(VH)和輕鏈可變區(VL)連接。鉸鏈區(Hinge Region): 鉸鏈區通常源自CD8或CD28序列,提供了CAR分子的柔韌性,使其能夠在識別抗原時進行適當的構象變化。跨膜區(Transmembrane Region): 跨膜區負責將CAR分子嵌入細胞膜,通常也來源于CD8或CD28序列。胞內激活區(Intracellular Activation Domain): 大多數CAR分子的胞內激活區由CD3ζ和41-BB或CD28區域組成,負責將抗原識別信號轉導到細胞內部,激活細胞的免疫反應。在CAR-M的設計中,研究人員探索了多種胞內激活區,以賦予CAR-M不同的抗腫瘤能力:吞噬域(Phagocytosis Domains): 將FcRγ、CD3ζ或Megf10等吞噬域整合到CAR中,使巨噬細胞能夠吞噬抗原特異性的靶細胞并抑制腫瘤進展。PI3K招募域(PI3K Recruiting Domain):FcRγ和PI3K招募域的串聯能夠實現對整個細胞的吞噬。跨膜區和胞內域(Transmembrane and Intracellular Domain):CD147的跨膜區和胞內域用于CAR-M設計,能夠分泌基質金屬蛋白酶,幫助免疫細胞滲透腫瘤組織。炎癥信號傳導域(Inflammatory Signaling Domains): 將TLR4或TLR2的胞內信號傳導域整合到CAR框架中,能夠誘導巨噬細胞向M1型極化,展現出抗腫瘤效應。共刺激域和炎癥細胞因子(Costimulatory Domain and Inflammatory Cytokine): 含有CD28共刺激域、CD3ζ吞噬域以及通過切割位點釋放的M1型細胞因子IFN-γ的串聯CAR分子,能夠通過吞噬和促炎性抗腫瘤效應抑制腫瘤進展。CD3ζ和TLR4胞內域的共表達(Co-expression of CD3ζ and TLR4 Intracellular Domain): 增強了巨噬細胞吞噬靶細胞的能力,并促進M1型極化。早在2006年,Biglari等人就成功將CEA(癌胚抗原)靶向的CAR分子導入人類單核細胞,并證明了這種療法的可行性和安全性。自此之后,研究人員一直致力于開發和優化CAR-巨噬細胞療法。初步研究表明,CAR-M治療在血液腫瘤和非血液腫瘤的管理中具有潛力。目前,已有兩種CAR-M療法(CT-0508和MCY-M11)獲得美國食品藥品監督管理局(FDA)的批準進入臨床試驗階段。這標志著CAR-M療法在實際臨床應用中的重要一步。盡管CAR-M療法在血液腫瘤治療中展示了潛力,但其在實體瘤中的應用仍面臨諸多挑戰。首先,實體瘤的致密組織結構和復雜的腫瘤微環境限制了CAR-M細胞的浸潤和殺傷效應。其次,巨噬細胞在腫瘤微環境中容易被“教育”成支持腫瘤生長的M2型巨噬細胞,削弱其抗腫瘤功能。為了克服這些問題,研究人員正在探索多種策略,如優化CAR結構、結合其他免疫療法以及利用生物材料輔助CAR分子的遞送等。巨噬細胞在免疫系統中扮演著多重角色,包括吞噬病原體和癌細胞、分泌細胞因子和趨化因子以及調節免疫反應等。這些特性使巨噬細胞成為CAR免疫療法的理想候選者。研究表明,CAR-M細胞不僅具有直接吞噬癌細胞的能力,還能夠通過抗原呈遞功能激活T細胞等適應性免疫反應,進一步增強抗腫瘤效果。為了提高CAR-M療法的效果,研究人員正在不斷優化CAR的設計和巨噬細胞的工程改造。例如,通過引入不同的胞內信號傳導區,如CD3ζ、FcRγ等,可以增強巨噬細胞的吞噬能力和抗腫瘤活性。此外,結合原位基因編輯(In Situ Gene Editing)、合成生物學(Synthetic Biology)和生物材料輔助基因遞送等先進技術,可以進一步提升CAR-M療法的安全性和有效性。使用脂質納米顆粒(Lipid Nanoparticles, LNPs)在體外系統中將編碼CAR的mRNA遞送至巨噬細胞和T細胞(Credit: Molecular Cancer)
這個系統主要是為了提高基因編輯的效率,使得這些免疫細胞能夠高效表達CAR分子,從而增強其抗腫瘤活性。LNPs是一種先進的基因遞送工具,其使用在mRNA疫苗(如新冠病毒疫苗)的成功應用引起了廣泛關注。LNPs的優點包括高遞送效率、低毒性和良好的生物相容性。研究人員利用LNPs將編碼CAR分子的mRNA遞送至巨噬細胞和T細胞,從而使這些細胞能夠特異性識別并殺傷腫瘤細胞。研究中,研究人員首先優化了LNPs的組成和mRNA的修飾,以提高其在巨噬細胞和T細胞中的轉染效率。具體來說,他們篩選了一組脂質和mRNA,發現將磷脂酰乙醇胺(DOPE)摻入LNPs中對于核酸的遞送至關重要。通過體外實驗,研究人員證明這種優化的LNP-mRNA系統能夠有效地將CAR mRNA遞送至小鼠巨噬細胞和人類CD8+ T細胞,使這些細胞在表達CAR分子后表現出顯著的細胞毒性作用,能夠有效殺傷B細胞淋巴瘤細胞。除了優化CAR-M細胞本身,研究人員還探索將CAR-M療法與其他免疫療法結合使用,以實現協同抗腫瘤效果。例如,將CAR-M細胞與CAR-T細胞聯合使用,可以利用巨噬細胞的腫瘤浸潤能力和T細胞的強大殺傷能力,形成互補優勢。此外,結合檢查點抑制劑(Checkpoint Inhibitors)如抗PD-1抗體Pembrolizumab(帕博利珠單抗),可以進一步解除腫瘤微環境的免疫抑制,提高治療效果。隨著CAR-M療法的不斷發展,越來越多的臨床試驗正在進行中,以評估其在不同類型癌癥中的效果和安全性。CT-0508和MCY-M11是目前進展最快的兩種CAR-M療法,它們已獲得FDA的批準進入臨床試驗,用于治療HER2過表達的復發性或轉移性實體瘤以及復發性/難治性卵巢癌和腹膜間皮瘤。初步臨床數據表明,CT-0508在患者中表現出良好的安全性和耐受性,沒有明顯的劑量相關毒性。此外,CAR-M療法在局部遞送時顯示出更好的腫瘤抑制效果,這為未來的實體瘤治療提供了新思路。盡管CAR-M療法在癌癥治療中展示了巨大的潛力,但其在臨床應用中仍面臨許多挑戰。未來的研究需要繼續優化CAR-M細胞的設計,提高其抗腫瘤效能,減少潛在的副作用。此外,探索更多高效的基因遞送系統和聯合治療策略,將有助于推動CAR-M療法在臨床上的廣泛應用。隨著基因編輯技術、合成生物學和生物材料科學的不斷進步,我們有理由相信,CAR-M療法將在不久的將來為癌癥患者帶來新的希望和更好的治療選擇。通過不斷的研究和臨床驗證,CAR-M療法有望成為癌癥免疫治療的重要組成部分,為攻克實體瘤這一難題提供有力的武器。巨噬細胞CAR療法作為一種新興的癌癥免疫治療方法,展示了巨大的應用潛力。盡管面臨諸多挑戰,但通過研究人員的不懈努力和技術的不斷進步,我們有理由相信,CAR-M療法將在未來的癌癥治療中發揮越來越重要的作用,為更多的患者帶來生的希望。Li N, Geng S, Dong ZZ, Jin Y, Ying H, Li HW, Shi L. A new era of cancer immunotherapy: combining revolutionary technologies for enhanced CAR-M therapy. Mol Cancer. 2024 Jun 1;23(1):117. doi: 10.1186/s12943-024-02032-9. PMID: 38824567.
https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-024-02032-9